Ο ιατρός Γεώργιος Κέκος, κατέχει απόλυτη εξειδίκευση στις παθήσεις του θυρεοειδούς αδένα. Πραγματοποιεί με άψογο τρόπο όλες τις σύγχρονες μεθόδους διάγνωσης και θεραπείας του θυρεοειδούς, που περιγράφονται στην παρούσα σελίδα. Έχει μεγάλη εμπειρία στην αντιμετώπιση των θυρεοειδικών παθήσεων, εφαρμόζοντας εξατομικευμένα σε κάθε ασθενή την κατάλληλη θεραπεία.
Εμπιστευθείτε το πρόβλημα σας για μια αποτελεσματική και οριστική διευθέτηση με σύγχρονες μεθόδους θεραπείας, σύμφωνα με τις αρχές της χειρουργικής επιστήμης, που βασίζονται σε επιστημονικές αποδείξεις (Evidence Based Surgery). Η υψηλή μας επιστημονική κατάρτιση και η πολύχρονη εμπειρία εγγυώνται την άριστη λύση με ανώδυνο τρόπο και χωρίς ταλαιπωρία.
Ο ιατρός δέχεται και εξετάζει τους ασθενείς στο ιατρείο του, επί της οδού Κερασούντος, αριθμός 4, στην Αθήνα. Συνεργάζεται με όλες τις ιδιωτικές ασφαλιστικές εταιρείες και, όταν χρειάζεται, νοσηλεύει τους ασθενείς σε σύγχρονες ιδιωτικές κλινικές που είναι συμβεβλημένες και με το ΕΟΠΥΥ.
Για περισσότερες πληροφορίες επικοινωνήστε μαζί μας στο τηλέφωνο
2107486937
Εισαγωγή
Επιδημιολογία
 Ο καρκίνος του θυρεοειδούς εμφανίζεται με συχνότητα μικρότερη από 1% επί του συνόλου των κακοήθων παθήσεων του ανθρώπου. Αποτελεί την συχνότερη κακοήθεια των ενδοκρινών αδένων αποτελώντας το 95% επί του συνόλου των περιστατικών. Ο επιπολασμός είναι 40 νέες περιπτώσεις ανά δέκα εκατομμύρια πληθυσμού το χρόνο και συμβαίνουν 6 θάνατοι ανά δέκα εκατομμύρια κατοίκους κάθε έτος.
Ο καρκίνος του θυρεοειδούς εμφανίζεται με συχνότητα μικρότερη από 1% επί του συνόλου των κακοήθων παθήσεων του ανθρώπου. Αποτελεί την συχνότερη κακοήθεια των ενδοκρινών αδένων αποτελώντας το 95% επί του συνόλου των περιστατικών. Ο επιπολασμός είναι 40 νέες περιπτώσεις ανά δέκα εκατομμύρια πληθυσμού το χρόνο και συμβαίνουν 6 θάνατοι ανά δέκα εκατομμύρια κατοίκους κάθε έτος.
Ο καρκίνος του θυρεοειδούς αναπτύσσεται ταχύτερα από κάθε άλλη μορφή καρκίνου με ρυθμό ετήσιας αύξησης 4,3%. Αν και η νόσος αφορά όλες τις φυλετικές ομάδες, η μεγαλύτερη καταγράφεται μεταξύ των λευκών ανδρών. Το φάσμα της βιολογικής συμπεριφοράς του καρκίνου του θυρεοειδούς ποικίλλει από την ήπια πορεία του θηλώδους καρκινώματος μέχρι την πολύ επιθετική του αμετάπλαστου καρκινώματος.
Αίτια
 Η αιτία των περισσοτέρων θυρεοειδικών καρκίνων είναι άγνωστη. Τα άτομα που έχουν λάβει θεραπευτική δόση ακτινοβολίας στο θύμο, στις αμυγδαλές, στο κρανίο και στο δέρμα στην βρεφική, στην παιδική και στην εφηβική ηλικία παρουσιάζουν αυξημένο κίνδυνο ανάπτυξης θυρεοειδικών όγκων. Ο θυρεοειδής αδένας των παιδιών είναι πολύ πιο ευάλωτος στην καρκινογόνο δράση της ακτινοβολίας παρά ο θυρεοειδής των ενηλίκων, όπως αποδείχθηκε από το πυρηνικό ατύχημα στο Chernobyl. Ωστόσο, οι ενήλικες έως 50 ετών οι οποίοι εκτέθηκαν στην ακτινοβολία μετά την ατομική έκρηξη στην Hiroshima είχαν αυξημένη επίπτωση καλοήθων και κακοήθων όγκων. Η επίπτωση του θυρεοειδικού καρκίνου είναι υψηλή τα επόμενα τουλάχιστον 30 έτη μετά την ακτινοβόληση. Ακτινοβολία χορηγείται και με το ραδιενεργό ιώδιο-131 που δίνεται για θεραπευτικούς σκοπούς. Ωστόσο, καρκινώματα μετά από ιατρική χορήγηση ραδιενεργού ιωδίου-131 για διαγνωστικούς και θεραπευτικούς σκοπούς δεν φαίνεται να είναι συχνότερα απ’ ό,τι στο γενικό πληθυσμό. Πιθανότατα για να εκδηλωθεί καρκινογόνος δράση του ραδιενεργού ιωδίου-131 προαπαιτείται το άτομο να βρίσκεται σε νεαρή ηλικία και η δόση μεγάλη.
Η αιτία των περισσοτέρων θυρεοειδικών καρκίνων είναι άγνωστη. Τα άτομα που έχουν λάβει θεραπευτική δόση ακτινοβολίας στο θύμο, στις αμυγδαλές, στο κρανίο και στο δέρμα στην βρεφική, στην παιδική και στην εφηβική ηλικία παρουσιάζουν αυξημένο κίνδυνο ανάπτυξης θυρεοειδικών όγκων. Ο θυρεοειδής αδένας των παιδιών είναι πολύ πιο ευάλωτος στην καρκινογόνο δράση της ακτινοβολίας παρά ο θυρεοειδής των ενηλίκων, όπως αποδείχθηκε από το πυρηνικό ατύχημα στο Chernobyl. Ωστόσο, οι ενήλικες έως 50 ετών οι οποίοι εκτέθηκαν στην ακτινοβολία μετά την ατομική έκρηξη στην Hiroshima είχαν αυξημένη επίπτωση καλοήθων και κακοήθων όγκων. Η επίπτωση του θυρεοειδικού καρκίνου είναι υψηλή τα επόμενα τουλάχιστον 30 έτη μετά την ακτινοβόληση. Ακτινοβολία χορηγείται και με το ραδιενεργό ιώδιο-131 που δίνεται για θεραπευτικούς σκοπούς. Ωστόσο, καρκινώματα μετά από ιατρική χορήγηση ραδιενεργού ιωδίου-131 για διαγνωστικούς και θεραπευτικούς σκοπούς δεν φαίνεται να είναι συχνότερα απ’ ό,τι στο γενικό πληθυσμό. Πιθανότατα για να εκδηλωθεί καρκινογόνος δράση του ραδιενεργού ιωδίου-131 προαπαιτείται το άτομο να βρίσκεται σε νεαρή ηλικία και η δόση μεγάλη.
Μετά από κάθε πυρηνική έκρηξη ή άλλη μόλυνση του περιβάλλοντος με ραδιοϊώδιο, συστήνεται η χορήγηση σταθερού ιωδίου στο πληθυσμό. Το ιώδιο αυτό ελαττώνει την πρόσληψη ραδιοϊωδίου από το θυρεοειδή με αποτέλεσμα το ραδιοϊώδιο που προσλαμβάνουν άθελά τους τα εκτεθειμένα άτομα, αντί να οδεύσει στον θυρεοειδή αποβάλλεται με τα ούρα. Η ελάχιστη δόση ιωδιούχου καλίου που αναχαιτίζει την θυρεοειδική πρόσληψη του ραδιοϊωδίου είναι 40mg.
Ως αιτιοπαθογενετικός παράγοντας στα θυρεοειδικά καρκινώματα θεωρείται η θυρεοειδοτρόπος ορμόνη (TSH). Γι’ αυτό στις δυσορμονογενετικές βρογχοκήλες που συνοδεύονται από υποθυρεοειδισμό, μεγάλη αύξηση της TSH στον ορό και έντονη υπερπλασία του αδένα, αναπτύσσονται με μεγαλύτερη συχνότητα θυρεοειδικά καρκινώματα.
Ταξινόμηση
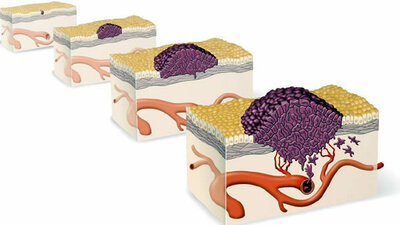 Η ταξινόμηση και η κατηγοριοποίηση των κακοηθών όγκων του θυρεοειδούς αδένα είναι καίριας σημασίας, επειδή οι θυρεοειδικοί καρκίνοι παρουσιάζουν ένα ευρύ φάσμα δυναμικού ανάπτυξης και κακοήθους συμπεριφοράς. Στο ένα άκρο κείται το θηλώδες καρκίνωμα, το οποίο συνήθως εμφανίζεται σε νέους ενήλικες, εξελίσσεται με αργό ρυθμό, μεθίσταται στους περιοχικούς λεμφαδένες και έχει μακροχρόνια επιβίωση ακόμα και επί μεταστάσεων. Στο άλλο άκρο βρίσκεται το αδιαφοροποίητο καρκίνωμα, το οποίο εμφανίζεται σε άτομα μεγάλης ηλικίας και είναι ένα διηθητικό νεόπλασμα που αποτελείται από μικρά και μεγάλα αμετάπλαστα κύτταρα. Οι περισσότεροι ασθενείς με αμετάπλαστο θυρεοειδικό καρκίνωμα καταλήγουν λόγω τοπικής υποτροπής ή πνευμονικών μεταστάσεων σε χρόνο μικρότερο από 9 μήνες από την διάγνωση. Μεταξύ των δύο αυτών ακραίων νοσολογικών οντοτήτων τοποθετούνται τα θυλακιώδη καρκινώματα, τα καρκινώματα από τα οξεόφιλα κύτταρα του Hurthle, τα μυελοειδή καρκινώματα, τα σαρκώματα, τα λεμφώματα και οι μεταστατικοί όγκοι.
Η ταξινόμηση και η κατηγοριοποίηση των κακοηθών όγκων του θυρεοειδούς αδένα είναι καίριας σημασίας, επειδή οι θυρεοειδικοί καρκίνοι παρουσιάζουν ένα ευρύ φάσμα δυναμικού ανάπτυξης και κακοήθους συμπεριφοράς. Στο ένα άκρο κείται το θηλώδες καρκίνωμα, το οποίο συνήθως εμφανίζεται σε νέους ενήλικες, εξελίσσεται με αργό ρυθμό, μεθίσταται στους περιοχικούς λεμφαδένες και έχει μακροχρόνια επιβίωση ακόμα και επί μεταστάσεων. Στο άλλο άκρο βρίσκεται το αδιαφοροποίητο καρκίνωμα, το οποίο εμφανίζεται σε άτομα μεγάλης ηλικίας και είναι ένα διηθητικό νεόπλασμα που αποτελείται από μικρά και μεγάλα αμετάπλαστα κύτταρα. Οι περισσότεροι ασθενείς με αμετάπλαστο θυρεοειδικό καρκίνωμα καταλήγουν λόγω τοπικής υποτροπής ή πνευμονικών μεταστάσεων σε χρόνο μικρότερο από 9 μήνες από την διάγνωση. Μεταξύ των δύο αυτών ακραίων νοσολογικών οντοτήτων τοποθετούνται τα θυλακιώδη καρκινώματα, τα καρκινώματα από τα οξεόφιλα κύτταρα του Hurthle, τα μυελοειδή καρκινώματα, τα σαρκώματα, τα λεμφώματα και οι μεταστατικοί όγκοι.
Επομένως, οι καρκίνοι του θυρεοειδούς που έχουν προέλευση από τα επιθηλιακά κύτταρα των θυλακίων ταξινομούνται στις ακόλουθες κατηγορίες:
- Θηλώδης καρκίνος (αμιγής και μικτός τύπος με θυλακιώδη κύτταρα)
- Θυλακιώδης καρκίνος
- Καρκίνος από κύτταρα Huerthle
- Μυελοειδής καρκίνος από τα παραθυλακικά ή κύτταρα C
- Αμετάπλαστοι όγκοι
Καρκινώματα στον θυρεοειδή ενδέχεται να αναπτυχθούν και από άλλους ιστούς, όπως είναι τα λεμφώματα και οι μεταστατικού όγκοι.
 Το 90% – 95% των θυρεοειδικών καρκίνων ανήκουν στους καλά διαφοροποιημένους όγκους, οι οποίοι εκπορεύονται από τα θυλακιώδη επιθηλιακά κύτταρα και χαρακτηρίζονται από μακροχρόνια επιβίωση. Σε αυτούς περιλαμβάνονται οι θηλώδεις (70%), οι θυλακιώδεις (20%) και οι καρκίνοι από κύτταρα Hurthle. Οι μυελώδεις καρκίνοι (MTC) αποτελούν το 6% των καρκίνων του θυρεοειδούς (από τους οποίους το 25% έχουν οικογενή βάση: ΜΕΝ2 και ΜΕΝ3). Το αμετάπλαστο καρκίνωμα του θυρεοειδούς είναι ένα λίαν επιθετικό καρκίνωμα που αφορά λιγότερο από το 4% των θυρεοειδικών καρκίνων.
Το 90% – 95% των θυρεοειδικών καρκίνων ανήκουν στους καλά διαφοροποιημένους όγκους, οι οποίοι εκπορεύονται από τα θυλακιώδη επιθηλιακά κύτταρα και χαρακτηρίζονται από μακροχρόνια επιβίωση. Σε αυτούς περιλαμβάνονται οι θηλώδεις (70%), οι θυλακιώδεις (20%) και οι καρκίνοι από κύτταρα Hurthle. Οι μυελώδεις καρκίνοι (MTC) αποτελούν το 6% των καρκίνων του θυρεοειδούς (από τους οποίους το 25% έχουν οικογενή βάση: ΜΕΝ2 και ΜΕΝ3). Το αμετάπλαστο καρκίνωμα του θυρεοειδούς είναι ένα λίαν επιθετικό καρκίνωμα που αφορά λιγότερο από το 4% των θυρεοειδικών καρκίνων.
Η πρόγνωση του θυρεοειδικού καρκίνου εξαρτάται από τον ιστολογικό τύπο, την ηλικία, το φύλο του ασθενούς, την έκταση της νόσου κατά την αρχική διάγνωση και από την ιδιότητα του όγκου να προσλαμβάνει ραδιενεργό ιώδιο. Κατά μέσο όρο, 5% των ασθενών με θηλώδες, 10% με θυλακιώδες, 15% με καρκίνωμα από κύτταρα Hurthle και 20% με μυελοειδές καρκίνωμα θα καταλήξουν εντός 10 ετών.
Η έκταση της χειρουργικής θεραπείας παραμένει ακόμα και στις μέρες μας επίκαιρο θέμα, με διιστάμενες απόψεις. Οι στόχοι της θεραπείας του καρκίνου του θυρεοειδούς περιλαμβάνουν τα ακόλουθα: 1) την ριζική αφαίρεση του πρωτοπαθούς όγκου και των διηθημένων τραχηλικών λεμφαδένων, 2) την ελαχιστοποίηση της νοσηρότητας που σχετίζεται με την νόσο και την θεραπεία, 3) την επακριβή σταδιοποίηση της νόσου, 4) την συμπληρωματική θεραπεία με ραδιενεργό ιώδιο, εκεί όπου ενδείκνυται, 5) την ελαχιστοποίηση του κινδύνου τοπικής ή απομακρυσμένης υποτροπής και 6) την μακροχρόνια επιβίωση.
Μοριακή γενετική της ογκογένεσης
 Κάθε νεόπλασμα αποτελεί μία απρόσφορη συσσώρευση κυττάρων που οφείλεται στην ανισορροπία μεταξύ του κυτταρικού πολλαπλασιασμού και του κυτταρικού θανάτου (απόπτωση). Η ανάπτυξη καρκίνου είναι το αποτέλεσμα μεταλλάξεων σε ένα ή περισσότερα από τα πολυάριθμα γονίδια που ρυθμίζουν τον κυτταρικό πολλαπλασιασμό και τον προγραμματισμένο κυτταρικό θάνατο (απόπτωση). Ο καρκίνος θεωρείται γενετικό νόσημα και εμφανίζεται, είτε σποραδικά ως αποτέλεσμα σωματικής μετάλλαξης είτε με οικογενή ή κληρονομική μορφή σε πολλά μέλη της ιδίας οικογένειας ως αποτέλεσμα γενετικών μεταλλάξεων.
Κάθε νεόπλασμα αποτελεί μία απρόσφορη συσσώρευση κυττάρων που οφείλεται στην ανισορροπία μεταξύ του κυτταρικού πολλαπλασιασμού και του κυτταρικού θανάτου (απόπτωση). Η ανάπτυξη καρκίνου είναι το αποτέλεσμα μεταλλάξεων σε ένα ή περισσότερα από τα πολυάριθμα γονίδια που ρυθμίζουν τον κυτταρικό πολλαπλασιασμό και τον προγραμματισμένο κυτταρικό θάνατο (απόπτωση). Ο καρκίνος θεωρείται γενετικό νόσημα και εμφανίζεται, είτε σποραδικά ως αποτέλεσμα σωματικής μετάλλαξης είτε με οικογενή ή κληρονομική μορφή σε πολλά μέλη της ιδίας οικογένειας ως αποτέλεσμα γενετικών μεταλλάξεων.
Τα γονίδια, οι μεταλλάξεις των οποίων ευθύνονται για την γένεση του καρκίνου (ογκογένεση), διακρίνονται σε δύο κατηγορίες: α) στα ογκογονίδια και β) στα ογκοκατασταλτικά γονίδια.
Ένα γονίδιο που συνεισφέρει άμεσα στην γένεση ενός όγκου καλείται ογκογονίδιο. Τα πρωτοογκογονίδια κωδικοποιούν κυτταρικές πρωτεΐνες, οι οποίες φυσιολογικά ελέγχουν το ρυθμό διαίρεσης των υγιών κυττάρων. Το ογκογονίδιο προέρχεται από το πρωτοογκογονίδιο μετά από μία γενετική μετάλλαξη. Μετά από αυτή την μετατροπή τα ογκογονίδια συνήθως κωδικοποιούν τροποποιημένους ή μεταλλαγμένους υποδοχείς στην κυτταρική μεμβράνη. Η μεταλλαγμένη δραστηριότητα αυτών των υποδοχέων μπορεί να έχει ως άμεσο αποτέλεσμα την απρόσφορη ανάπτυξη μέσω πληροφοριών που μετάγονται στον πυρήνα. Ως αποτέλεσμα όλων αυτών των διεργασιών, η φυσιολογική ανάπτυξη και η διαφοροποίηση κάθε κυτταρικής σειράς μπορεί να παρεκτραπεί προς κακοήθη εξαλλαγή. Επομένως, τα ογκογονίδια είναι μεταλλαγμένα πρωτοογκογονίδια, των οποίων η αλλοιωμένη έκφραση ευθύνεται για την ανάπτυξη κακοήθων όγκων, μέσω της ανεξέλεγκτης ενεργοποίησης του κυτταρικού πολλαπλασιασμού ή καταστολής της απόπτωσης.
Τα ογκοκατασταλτικά γονίδια φυσιολογικά δρουν ανασταλτικά στον πολλαπλασιασμό και στην ανάπτυξη των κυττάρων. Οι μεταλλάξεις σε αυτά τα γονίδια επιφέρουν την ανεξέλεγκτη ανάπτυξη και πολλαπλασιασμό των κυττάρων. Τα ογκοκατασταλτικά γονίδια φυσιολογικά περιορίζουν την κυτταρική ανάπτυξη με την ρύθμιση του πολλαπλασιασμού των κυττάρων, την επιδιόρθωση των λαθών ταιριάσματος του DNA και με τον έλεγχο του κυτταρικού θανάτου (απόπτωση). Ορισμένα ογκοκατασταλτικά γονίδια καταστέλλουν άμεσα τους όγκους, ρυθμίζοντας τον κυτταρικό κύκλο ή αναστέλλοντας την αύξηση μέσω κυτταρικών αλληλεπιδράσεων. Τα ογκοκατασταλτικά γονίδια αυτού του τύπου είναι τα λεγόμενα «γονίδια-φρουροί», γιατί ρυθμίζουν άμεσα την κυτταρική διαίρεση. Άλλα ογκοκατασταλτικά γονίδια, τα λεγόμενα «γονίδια κυτταρικής επιμέλειας»,συμμετέχουν στην επιδιόρθωση των λαθών αντιγραφής του DNA και έτσι προστατεύουν την ακεραιότητα και την σταθερότητα του γονιδιώματος. Η απώλεια της λειτουργίας τους οδηγεί στην συσσώρευση μεταλλάξεων σε ογκογονίδια και «γονίδια-φρουρούς», οι οποίες συνδυαστικά εκκινούν και προάγουν την ανάπτυξη του καρκίνου. Έχουν αναγνωρισθεί περίπου τα 30 ογκοκατασταλτικά γονίδια. Ένα από αυτά, το ΤΡ53, ευθύνεται για το 50% όλων των καρκίνων.
Ωστόσο, συνήθως χρειάζονται δύο χτυπήματα για την δημιουργία ενός όγκου. Η αρχική μετάλλαξη απενεργοποιεί το ένα αντίγραφο του γονιδίου και το δεύτερο συμβάν απενεργοποιεί το άλλο αλληλόμορφο μέσω διαφόρων μηχανισμών οι οποίοι περιλαμβάνουν μεταλλάξεις, διαγραφές, χρωμοσωματικές αναδιατάξεις ή μιτωτικούς ανασυνδυασμούς. Με τον μηχανισμό αυτό τα ογκοκατασταλτικά γονίδια καθίστανται λειτουργικώς ανενεργή.
Τα πιο πρόσφατη δεδομένα από την έρευνα για την κατανόηση του γενετικού μηχανισμού το οποίο οδηγεί στην ογκογένεση του θυρεοειδούς αδένα περιλαμβάνουν δύο βασικά πρότυπα: α) μεταλλαγμένα πρωτοογκογονίδια, τα οποία ως ογκογονίδια πλέον, επενεργούν στην τροποποιημένη πρωτεϊνική παραγωγή και διαμέσου αυτής στην πολλαπλασιαστική ικανότητα που οδηγεί στην κυτταρική αύξηση και β) οι μεταλλάξεις στα ογκοκατασταλτικά γονίδια που ευθύνονται για τον ανεξέλεγκτο κυτταρικό πολλαπλασιασμό.
Αρκετά ογκογονίδια και ογκοκατασταλτικά γονίδια εμπλέκονται στην ογκογένεση του θυρεοειδούς. Τα σημαντικότερα από αυτά είναι τα ακόλουθα:
- Πρωτοογκογονίδιο RΕΤ
- Υποδοχείς τυροσινικής κινάσης.
- Γονίδια RAS
- Υποδοχείς TSH
- Γονίδιο ΤΡ53
Πρωτοογκογονίδιο RΕΤ
Το RET πρωτοογκογονίδιο διαδραματίζει ουσιαστικό ρόλο στην αιτιοπαθογένεια των καρκίνων του θυρεοειδούς. Βρίσκεται στο χρωμόσωμα 10 και κωδικοποιεί τον υποδοχέα της τυροσινικής κινάσης στην κυτταρική μεμβράνη. Το εξωτερικό τμήμα του υποδοχέα περιέχει 28 υπολείμματα κυστεΐνης και δεσμεύει αρκετούς αυξητικούς παράγοντες, όπως είναι ο προερχόμενος από την νευρογλοία νευροτροφικός παράγοντας (GDNF). Το πρωτοογκογονίδιο RET συσχετίζεται με την διαφοροποίηση των νευρικών κυττάρων. Τα αρχέγονα νευρικά κύτταρα του φλοιού εμφανίζουν αυξημένη έκφραση αυτού του γονιδίου και αυτό είναι ευδιάκριτο σε ιστικά ευρήματα που βρέθηκαν σε νευροβλαστώματα, φαιοχρωμοκύττωμα και σε μυελώδη καρκίνο του θυρεοειδούς (MTC). Οι μεταβολές σε αυτό το γονίδιο έχουν ως αποτέλεσμα τις εξελικτικές ανωμαλίες σε έναν μεγάλο αριθμό από νευρικούς ιστούς, στους οποίους συμπεριλαμβάνεται το νευρικό τμήμα του γαστρεντερικού συστήματος, όπως συμβαίνει στην νόσο του Hirschsprung. Η έκφραση του ογκογονιδίου RET έχει ανιχνευθεί μόνο σε κακοήθεις ιστούς. Ασφαλώς δεν έχει βρεθεί σε κανένα επίπεδο της διαδικασίας μιας μη νεοπλασματικής πάθησης του θυρεοειδούς.
Το τμήμα τυροσινικής κινάσης του RET μπορεί να συγχωνευθεί με άλλα γονίδια μέσω αναδιάταξης. Αυτά τα παράγωγα από την συγχώνευση λειτουργούν ως ογκογονίδια και ενέχονται στην παθογένεια του θηλώδους καρκίνου (PTC). Έχουν περιγραφεί τουλάχιστον 15 αναδιατάξεις RET/PTC, οι οποίες αποτελούν πρώιμα συμβάντα στην ογκογένεση. Η ενεργοποίηση του ογκογονιδίου RET προβάλλεται ως τυπικό μοντέλο στην ανάπτυξη του θηλώδους καρκίνου. Οι ασθενείς με το μεταλλαγμένο αυτό ογκογονίδιο εμφανίζουν τον συμπαγή τύπο θηλώδους καρκίνου, που πρωτοεκδηλώνεται κλινικά σε προχωρημένο στάδιο, είναι περισσότερο επιθετικός και με απομακρυσμένες μεταστάσεις.
Η έκφραση των ογκογονιδίων RET σχετίζεται με τις διάφορες γεωγραφικές περιοχές. Η Ιαπωνία παρουσιάζει χαμηλή επίπτωση της έκφρασης του ογκογονιδίου RET στο θηλώδες καρκίνο του θυρεοειδούς (4%), ενώ στην Ιταλία ο επιπολασμός είναι μεγαλύτερος (35%). Η νεαρή ηλικία και η έκθεση στην ακτινοβολία θεωρούνται ανεξάρτητοι παράγοντες κινδύνου στην εμφάνιση των αναδιατάξεων RET/PTC. Έως και το 70% των θηλωδών καρκίνων σε παιδιά που είχαν εκτεθεί στην ακτινοβολία μετά το ατύχημα στο Chernobyl το 1986 έχουν αναδιατάξεις των RΕΤ/ΡΤC.
Οι γενετικές μεταλλάξεις της βλαστικής σειράς στα πρωτοογκογονίδια RET ευθύνονται για το ΜΕΝ2 και ΜΕΝ3 και τον οικογενή μυελοειδή καρκίνο του θυρεοειδούς. Σωματικές μεταλλάξεις έχουν εντοπισθεί σε σποραδικούς όγκους που προέρχονται από τον νευρικό ιστό, όπως είναι το MTC (30%) και το φαιοχρωμοκύττωμα.
Από τα προαναφερόμενα συνάγεται ότι το ογκογονίδιο RET αποτελεί ένα ειδικό γενετικό παράγοντα για τον θηλώδη καρκίνο του θυρεοειδούς αλλά υπάρχει μεγάλη γεωγραφική και εξαρτώμενη από το περιβάλλον έκθεση. Επίσης, μεταλλάξεις αυτού του γονιδίου συσχετίζονται με υψηλή συχνότητα σε ασθενείς με ΜΕΝ2 και ΜΕΝ3.
Υποδοχείς τυροσινικής κινάσης
Περισσότερες από 50 διαφορετικές πρωτεΐνες της τυροσινικής κινάσης κατηγοριοποιούνται ως ογκοπρωτεΐνες, απαρτίζοντας την μεγαλύτερη ομάδα ογκοπρωτεϊνών. Η ενεργοποίηση των υποδοχέων της τυροσυνικής κινάσης καταλύει έναν καταρράκτη γεγονότων, ο οποίος αποτελεί το έναυσμα για την κινητοποίηση μεταβολικών οδών με ποικίλα μεταβολικά αποτελέσματα. Τρεις διαφορετικές ομάδες υποδοχέων τυροσινικής κινάσης (RET, trk, και met) εμπλέκονται στην ανάπτυξη του θυρεοειδικού καρκίνου. Τα RET και trk αντιπροσωπεύουν διεργασίες ενεργοποιημένων πρωτοογκογονιδίων και το met την υπερέκφραση γονιδίου. Οι γενετικές αναλύσεις για αυτές τις μεταλλάξεις επιτρέπουν την πρώιμη και ασφαλή διάγνωση στα παιδιά με βεβαρυμμένο κληρονομικό ιστορικό, πριν την κλινική εμφάνιση του MTC.
Γονίδια RAS
Τα ογκογονίδια RAS κωδικοποιούν την σημειακή μεταγωγή G πρωτεϊνών. Οι μεταλλάξεις στα ογκογονίδια αυτά έχουν ως αποτέλεσμα την παραγωγή ενός ανενεργού ενζύμου (τριφωσφορική γουανοσίνη), το οποίο αδυνατεί πλέον να αναχαιτίσει την διάσπαση των πρωτεϊνών. Έτσι, η διαρκής ενεργοποίηση του μηχανισμού και η συνεχής συσσώρευση πρωτεϊνών συμβαίνει εξαιτίας μίας άστοχης ενζυμικής διαδικασίας. Περισσότεροι από 40% των θυρεοειδικών όγκων έχουν μία από τις τρείς σημειακές μεταλλάξεις στα γονίδια RAS (H-RAS, K-RAS, – RAS). Μεταλλάξεις RAS ανιχνεύονται τόσο σε καλοήθη όσο και κακοήθη νεοπλάσματα. Τα άτομα των ιωδοπενικών περιοχών εμφανίζουν ελαφρώς μειωμένη επίπτωση σε μεταλλάξεις στο γονίδιο RAS, σε σχέση με άτομα που ζουν σε περιοχές πλούσιες σε ιώδιο. Μεταλλαγμένα ογκογονίδια RAS έχουν αναγνωριστεί σε περισσότερα από το 40% των θυλακιωδών αδενωμάτων, θυλακιωδών καρκινωμάτων, των θηλωδών και αμετάπλαστων καρκινωμάτων του θυρεοειδούς. Ωστόσο, οι μεταλλάξεις του γονιδίου K-RAS παρατηρούνται πιο συχνά σε θηλώδεις καρκίνους που εμφανίζονται μετά από ακτινοβολία. Επιπρόσθετα, η ογκογένεση συσχετίζεται όχι μόνο με τις μεταλλάξεις των γονιδίων RAS αλλά επίσης και με άλλους γενετικούς και περιβαλλοντολογικούς παράγοντες, όπως είναι η επάρκεια σε ιώδιο.
Υποδοχείς TSH
Οι υποδοχείς TSH (ΤSH-R) αποτελούν μέλη ενός ζεύγους υποδοχέων της οικογένειας των G-πρωτεϊνών. Οι υποδοχείς αυτοί ελέγχουν την λειτουργία και την αύξηση των θυρεοειδικών κυττάρων διαμέσου της ενεργοποίησης των βιοχημικών οδών της αδενικής κυκλάσης και της φωσφολιπάσης C. Οι μεταβολές που ακολουθούν τις γενετικές μεταλλάξεις στο γονίδιο που είναι υπεύθυνο για τους TSH-R μελετήθηκαν σε ασθενείς με υπερπλασία του θυρεοειδούς. Μεταλλάξεις των TSH-R μπορούν να βρεθούν μέχρι και στο 80% των τοξικών αδενωμάτων, αλλά επίσης ανευρίσκονται σε υπερλειτουργικούς (θερμούς) όζους και σπανίως σε καρκίνους του θυρεοειδούς.
Γονίδιο ΤΡ53
Το γονίδιο ΤΡ53 είναι ένα ογκοκατασταλτικό γονίδιο που κωδικοποιεί έναν ρυθμιστή μεταγραφής, που διατηρεί τα κύτταρα στην φάση G1 του κυτταρικού κύκλου, επιτρέποντας την επιδιόρθωση του DΝΑ που έχει υποστεί βλάβη, συμβάλλοντας έτσι στην διατήρηση της γονιδιακής ακεραιότητας. Επίσης, το γονίδιο αυτό κωδικοποιεί μία φωσφοπρωτεΐνη η οποία εμποδίζει την έκφραση σημαντικών γονιδίων, τα οποία είναι υπεύθυνα για την φυσιολογική κυτταρική ανάπτυξη και διαφοροποίηση. Οι μεταλλάξεις του γονίδιο ΤΡ53 είναι σπάνιες στους θηλώδεις (PTC), αλλά είναι συχνές στους αδιαφοροποίητους αμετάπλαστους καρκίνους του θυρεοειδούς. Ακόμη, οι μεταλλάξεις στο γονίδιο ΤΡ53 αποτελούν μερικές από τις πιο κοινές γενετικές μεταλλάξεις που έχουν βρεθεί σε περισσότερους από 50 τύπους σε κυτταρικές σειρές με καρκινικά κύτταρα. Άλλοι ρυθμιστές και καταστολείς των όγκων, όπως είναι ο ΤΡ15 και ο ΤΡ16, μεταλλάσσονται συχνότερα στις κυτταρικές σειρές του θυρεοειδικού καρκίνου παρά στους πρωτοπαθείς όγκους.
Μεταλλάξεις του γονιδίου BRAF και του επαγωγέα της TERT
 Στην κατηγορία των διαφοροποιημένων καρκινωμάτων του θυρεοειδούς αδένα (ΔΚΘ) ανήκει α) το θηλώδες καρκίνωμα και β) το θυλακιώδες καρκίνωμα. Τα ΔΚΘ αποτελούν την συντριπτική πλειοψηφία των καρκινωμάτων του θυρεοειδούς αδένα (έως και 90%), και χαρακτηρίζονται από καλή πρόγνωση. Η 10ετής επιβίωση των ασθενών με θηλώδες καρκίνωμα είναι εξαιρετική και φθάνει το 95%. Σε αντιδιαστολή, οι ασθενείς που διαγιγνώσκονται με αδιαφοροποίητο ή αναπλαστικό καρκίνωμα του θυρεοειδούς έχουν κακή πρόγνωση.
Στην κατηγορία των διαφοροποιημένων καρκινωμάτων του θυρεοειδούς αδένα (ΔΚΘ) ανήκει α) το θηλώδες καρκίνωμα και β) το θυλακιώδες καρκίνωμα. Τα ΔΚΘ αποτελούν την συντριπτική πλειοψηφία των καρκινωμάτων του θυρεοειδούς αδένα (έως και 90%), και χαρακτηρίζονται από καλή πρόγνωση. Η 10ετής επιβίωση των ασθενών με θηλώδες καρκίνωμα είναι εξαιρετική και φθάνει το 95%. Σε αντιδιαστολή, οι ασθενείς που διαγιγνώσκονται με αδιαφοροποίητο ή αναπλαστικό καρκίνωμα του θυρεοειδούς έχουν κακή πρόγνωση.
Ποσοστό 17% των ασθενών με ΔΚΘ θα εμφανίσουν υποτροπή της νόσου και γι’ αυτό είναι ουσιαστικό να ταυτοποιηθούν οι ασθενείς υψηλού κινδύνου για υποτροπή της νόσου και στους οποίους θα πρέπει να εφαρμοσθεί μια πολύπλευρη και επιθετική θεραπευτική αντιμετώπιση.
Οι κλινικο-παθολογοανατομικές παράμετροι που χρησιμοποιούνται για την πρόβλεψη και την πρόγνωση των ασθενών με ΔΚΘ είναι: η ηλικία του ασθενούς, ο ιστολογικός υπότυπος, το μέγεθος του όγκου, η τοπική διήθηση, οι λεμφαδενικές και οι απομακρυσμένες μεταστάσεις. Ωστόσο, αυτές οι παράμετροι αδυνατούν να καθορίσουν με αξιοπιστία την πρόγνωση για κάθε ασθενή ξεχωριστά. Επιπλέον, δεν είναι πάντα γνωστές προεγχειρητικά ενώ μπορεί να είναι παρούσες τόσο σε μικρούς όσο και σε μεγάλου μεγέθους όγκους.
Κομβικό ρόλο για την πρόβλεψη και την πρόγνωση των ασθενών με ΔΚΘ διαδραματίζουν οι διάφορες γονιδιακές μεταλλάξεις που σχετίζονται με τον καρκίνο του θυρεοειδούς. Αυτές μπορούν ομαδοποιήσουν τους ασθενείς ανάλογα με τον κίνδυνο υποτροπής και να υπαγορεύσουν μία πιο επιθετική και επιμελημένη χειρουργική θεραπεία.
Από πλευράς ογκογενετικού μηχανισμού, δύο είναι τα σηματοδοτικά μονοπάτια που εμπλέκονται στην ανάπτυξη του καρκίνου του θυρεοειδούς: α) το μονοπάτι MAPK (mitogen-activated proteinkinase) και β) το μονοπάτι P13ΚΑΚΤ (phosphoinositide 3-kinases & protein kinase B). Και τα δύο αυτά σηματοδοτικά μονοπάτια παίζουν ρυθμιστικό ρόλο στον κυτταρικό πολλαπλασιασμό, στην διαφοροποίηση των καρκινικών κυττάρων και την συνολική επιβίωση. Το μονοπάτι MAPK συχνότερα ενεργοποιείται στον καρκίνο του θυρεοειδούς αδένα μέσω των μεταλλάξεων των γονιδίων BRAF και RAS, που είναι και οι πιο συχνές στον ΔΚΘ. Λιγότερο συχνές μεταλλάξεις που αφορούν στο μονοπάτι P13-AKT απαντώνται στο FTC, στο αδιαφοροποίητο και στον αναπλαστικό καρκίνο θυρεοειδούς.
Μεταλλάξεις του γονιδίου BRAF
Για πρώτη φορά το 2002 εντοπίστηκαν μεταλλάξεις του γονιδίου BRAF σε καρκινικά κύτταρα. Στις περισσότερες από αυτές τις μεταλλάξεις εμπλέκεται το κωδικόνιο 600 και ως αποτέλεσμα αυτό έχει την μετάλλαξη V600E, ενώ λιγότερο συχνά εντοπίζονται άλλες μεταλλάξεις όπως η μετάλλαξη Κ601Ε. Πολυάριθμες μελέτες επιβεβαίωσαν την ισχυρή συσχέτιση της μετάλλαξης BRAF και ειδικότερα της μετάλλαξης BRAF V600E με την επιθετική βιολογική συμπεριφορά του θηλώδους καρκινώματος.
Η μετάλλαξη έχει ανιχνευθεί στο 15% των ασθενών με ΔΚΘ και στο 40% των αδιαφοροποίητων καρκίνων του θυρεοειδούς αδένα. Επίσης, έχει εντοπισθεί και σε θηλώδη μικροκαρκινώματα μεγέθους <1cm. Ωστόσο, δεν έχει περιγραφεί στο θυλακιώδες, στο μυελλοειδές καρκίνωμα και σε καλοήθεις όγκους του θυρεοειδούς.
Η μετάλλαξη BRAF V600E έχει εστιάσει το επιστημονικό ενδιαφέρον και έχει αποτελέσει αντικείμενο εντατικής έρευνας τις τελευταίες δεκαετίες, λόγω της μεγάλης κλινικής σπουδαιότητας. Τονίζεται ότι η BRAF V600E μετάλλαξη σχετίζεται με επιθετικά κλινικοπαθολογοανατομικά χαρακτηριστικά του θηλώδους καρκινώματος, όπως για παράδειγμα είναι τα αυξημένα ποσοστά εξωθυρεοειδικής επέκτασης, μεγαλύτερο μέγεθος όγκου, αυξημένο ποσοστό διήθησης λεμφαδένων, υποτροπών, απομακρυσμένων μεταστάσεων και με πιο προχωρημένο στάδιο. Η μετάλλαξη αυτή συσχετίζεται με αυξημένη θνητότητα κυρίως σε ηλικιωμένους ασθενείς. Ωστόσο δεν μπορεί να θεωρηθεί ανεξάρτητος προγνωστικός παράγοντας.
Με βάση τα προαναφερόμενα η μετάλλαξη BRAF V600E αποτελεί από μόνη της έναν ευαίσθητο, αλλά όχι ειδικό δείκτη, τόσο για την διάγνωση του θηλώδους καρκινώματος όσο και για την πρόγνωση της υποτροπής και της θνητότητας των ασθενών με καρκίνο του θυρεοειδούς. Αυτό συμβαίνει επειδή, παρά την αυξημένη διάγνωση ασθενών θετικών στην συγκεκριμένη μετάλλαξη, η συνολική επιβίωση των ασθενών με ΔΚΘ είναι εξαιρετικά υψηλή και η θνητότητα πολύ χαμηλή.
Μετάλλαξη του επαγωγέα της TERT
H TERT (telomeRASe reverse transcriptase) αποτελεί μία υπομονάδα του ενζύμου τελομεράση, η κύρια λειτουργία της οποίας είναι η προσθήκη τελομερών στο τέλος των χρωμοσωμάτων, διατηρώντας με αυτό τον τρόπο την ακεραιότητα των χρωμοσωμάτων και την σταθερότητα των γονιδίων κατά την μίτωση. Η τελομεράση ως γνωστόν εκφράζεται στα αρχέγονα κύτταρα και στα βλαστοκύτταρα, αλλά λιγότερο συχνά εκφράζεται και σε ορισμένα σωματικά κύτταρα. Η απώλεια των τελομερών παρατηρείται σε κάθε κύκλο κυτταρικής διαίρεσης, οδηγώντας τα κύτταρα σε κατάσταση γήρανσης, όταν το επιθυμητό μήκος των τελομερών έχει προσεγγιστεί.
Η τελομεράση επανενεργοποιείται σε πολλούς καρκίνους, γεγονός που δεν επιτρέπει την ύπαρξη του κατάλληλου ελέγχου του μήκους των τελομερών και έτσι τα καρκινικά κύτταρα αποκτούν την λεγόμενη αναπαραγόμενη αθανασία. Η πρωτεΐνη TERT παίζει σημαντικό ρόλο στην ενεργοποίηση της τελομεράσης σε μια κακοήθη μετάλλαξη των κυττάρων. Με την ιδιότητα αυτή εμπλέκεται στην διαδικασία της ογκογένεσης.
Η μετάλλαξη του επαγωγέα του TERT ανιχνεύθηκε για πρώτη φορά το 2013 σε ασθενή με μελάνωμα και αργότερα σε ασθενείς με καρκίνο ουροδόχου κύστης και γλοιοβλάστωμα. Οι πιο συχνά υπεύθυνες μεταλλάξεις του επαγωγέα της TERT για τους ανθρώπινους καρκίνους είναι οι C228T και C250T. Δεν φαίνεται να υπάρχει επικάλυψη μεταξύ των TERT C228T και C250T μεταλλάξεων, με την πρώτη να είναι πιο συχνή στον καρκίνο του θυρεοειδούς σε σχέση με την δεύτερη. Η αμοιβαία αποκλειστικότητα των δύο αυτών μεταλλάξεων υποδηλώνει ότι και οι δύο παίζουν σημαντικό ρόλο στην ογκογένεση στον καρκίνο του θυρεοειδούς αδένα, χωρίς όμως να μπορεί να τεκμηριωθεί ποια από τις δύο είναι πιο ισχυρή στην διαδικασία αυτή. Ειδικότερα, η συχνότητα της μετάλλαξης C228T σε σύγκριση με αυτή της C250T είναι μεγαλύτερη στο θηλώδες, στο θυλακιώδες, στο αδιαφοροποίητο καρκίνωμα αλλά και στον αναπλαστικό καρκίνο θυρεοειδούς.
Έχει διαπιστωθεί ότι η μετάλλαξη ανευρίσκεται τόσο σε θηλώδη όσο και σε θυλακιώδη καρκινώματα, ενώ η παντελής έλλειψη της συγκεκριμένης μετάλλαξης σε καλοήθεις θυρεοειδικούς όζους, αναδεικνύει την ειδικότητα της μετάλλαξης του επαγωγέα του TERT στην διάγνωση του καρκίνου του θυρεοειδούς αδένα. Επίσης, η εξαιρετικά υψηλή συχνότητα της μετάλλαξης του επαγωγέα του TERT στον αδιαφοροποίητο και στον αναπλαστικό καρκίνο θυρεοειδούς, υποδηλώνει την πιθανή εμπλοκή της μετάλλαξης αυτής στην αποδιαφοροποίηση των ΔΚΘ.
Οι όγκοι με μεταλλάξεις του επαγωγέα της TERT εμφανίζονται συχνότερα σε άτομα μεγάλης ηλικίας και χαρακτηρίζονται από μεγάλο μέγεθος, διήθηση αγγείων, εξωθυρεοειδική επέκταση, λεμφαδενική διασπορά, επιθετική βιολογική συμπεριφορά, προχωρημένα στάδια της νόσου με απομακρυσμένες μεταστάσεις. Η μετάλλαξη του επαγωγέα της TERT επίσης σχετίζεται με αυξημένη θνητότητα και μικρότερη επιβίωση στο θηλώδες καρκίνωμα καθώς και σε άλλα είδη καρκίνου του θυρεοειδούς.
Η μετάλλαξη του επαγωγέα της TERT, όπως και η BRAF V600E μετάλλαξη, σχετίζεται με την υποτροπή του καρκίνου, αλλά το ποσοστό εμφάνισης δεύτερης υποτροπής φαίνεται να είναι εξαιρετικά υψηλό σε ασθενείς με μετάλλαξη του επαγωγέα του TERT, και όχι BRAF V600E μετάλλαξη. Το θηλώδες καρκίνωμα με μετάλλαξη BRAF V600E και μετάλλαξη του επαγωγέα του TERT παρουσιάζει πολύ πιο αυξημένα ποσοστά θανάτου σχετιζόμενα με το καρκίνο, σε σύγκριση με τους ασθενείς που έχουν μόνο την μία από τις δύο μεταλλάξεις.
Η μετάλλαξη BRAF V600E κατέχει σημαντικό ρόλο στην καρκινογένεση μέσω του μονοπατιού της ΜΑPK. Το γεγονός ότι πολύ συχνά συνυπάρχουν μεταλλάξεις BRAF V600E και του επαγωγέα του TERT σε ΔΚΘ, υποδηλώνει την πιθανή εμπλοκή και της μετάλλαξης του επαγωγέα του TERT στο σηματοδοτικό μονοπάτι της MAPK, και συνεπώς στην ανάπτυξη ενός ΔΚΘ με πιο επιθετική βιολογική συμπεριφορά. Γι’ αυτό τον λόγο και οι πιο επιθετικές μορφές καρκίνου θυρεοειδούς, όπως είναι ο αναπλαστικός τύπος, χαρακτηρίζονται από συνύπαρξη μετάλλαξης BRAF V600E και μετάλλαξης του επαγωγέα του TERT. Ενδιαφέρουσα είναι η επισήμανση ότι αυτές οι μεταλλάξεις εμφανίζονται πριν από την αναπλαστική εξαλλαγή του καρκινώματος.
Επιπρόσθετα, η συνύπαρξη μετάλλαξης BRAF και μεταλλάξεων του επαγωγέα της TERT σχετίζεται με αντοχή στην θεραπεία με ραδιενεργό ιώδιο και στην υποτροπή του θηλώδους καρκινώματος. Με τον τρόπο αυτό αναδεικνύεται η αξία της ανίχνευσης των μεταλλάξεων αυτών στην πρόβλεψη ενδεχόμενης αποτυχίας της θεραπείας με ραδιενεργό ιώδιο και συνεπώς την υιοθέτηση μιας πιο επιθετικής χειρουργικής στρατηγικής.
Κλινική αξιολόγηση των μεταλλάξεων BRAF V600E και του επαγωγέα της TERT
Έχει μελετηθεί η σχέση των μεταλλάξεων BRAF V600E και του επαγωγέα του TERT με τα υπερηχογραφικά χαρακτηριστικά των όζων. Το θηλώδες καρκίνωμα με μετάλλαξη BRAF V600E έχει την τάση να παρουσιάζει πιο συχνά την χαρακτηριστική διαμόρφωση taller than wider και μικρολοβωτά ανώμαλα όρια.
Η ταυτόχρονη μετάλλαξη BRAF V600E και του επαγωγέα του TERT σχετίζονται με επιθετικές μορφές καρκίνου του θυρεοειδούς. Η δυνατότητα προεγχειρητικής αναγνώρισης αυτού του μοριακού προφίλ θα μπορούσε να τροποποιήσει τον θεραπευτικό σχεδιασμό των ασθενών, επειδή σχετίζονται με αντοχή στην θεραπεία με ραδιενεργό ιώδιο και εμφανίζουν υψηλή συχνότητα υποτροπών και μακρινών μεταστάσεων. Τόσο η χειρουργική θεραπεία όσο και η μετεγχειρητική παρακολούθηση θα πρέπει να είναι εκτεταμένη και εντατική, αντιστοίχως. Πολλοί συγγραφείς εντάσσουν την μετάλλαξη του επαγωγέα της TERT στις παραμέτρους που προμηνύουν αυξημένο κίνδυνο υποτροπής μετά την αρχική θεραπεία του καρκίνου του θυρεοειδούς. Με αυτό τον τρόπο, η «μοριακή ταυτότητα» και τα κλινικοπαθολογοανατομικά χαρακτηριστικά του κάθε όγκου, πιθανά να επιτρέψουν στους κλινικούς ιατρούς την ορθολογική και πιο εξατομικευμένη θεραπευτική διαχείριση των ασθενών.
Μολονότι η συνύπαρξη των μεταλλάξεων του BRAF και του επαγωγέα του TERT συσχετίζεται με πιο επιθετική νόσο, ταυτόχρονα μπορεί να αποτελεί και ένα ισχυρό πλεονέκτημα για την υποκατηγορία αυτή των ασθενών. Πράγματι, νέες καινοτόμες στοχευμένες θεραπείες έχουν σχεδιαστεί για συγκεκριμένους μοριακούς στόχους, όπως είναι το BRAF V600E, υποσχόμενα ελπιδοφόρα αποτελέσματα ακόμα και για τα αναπλαστικά καρκινώματα του θυρεοειδούς. Γνωρίζοντας την συνέργεια των δύο αυτών μεταλλάξεων, διαγράφεται ένας νέος φωτεινός ορίζοντας για την ανάπτυξη στοχευμένων θεραπειών και για το γονίδιο TERT, εμπλουτίζοντας έτσι την θεραπευτική φαρέτρα με αποτελεσματικά φάρμακα έναντι αυτών των επιθετικών και με κακή πρόγνωση καρκίνων του θυρεοειδούς.
Παρά το γεγονός ότι η BRAF V600E μετάλλαξη έχει εστιάσει την προσοχή των επιστημόνων τα τελευταία χρόνια, φαίνεται ότι δεν μπορεί να προβλέψει αξιόπιστα το κλινικό μακροπρόθεσμο αποτέλεσμα σε κάθε ασθενή. Η μετάλλαξη BRAF V600E από μόνη της μπορεί να είναι ευαίσθητη, αλλά όχι ειδική ως δείκτης υποτροπής της νόσου και θνητότητας. Τέλος, η προσθήκη αυτών των δύο γονιδιακών μεταλλάξεων στα κλασσικά κλινικοπαθολοοανατομικά χαρακτηριστικά κατά την αξιολόγηση των ασθενών με καρκίνο θυρεοειδούς, πιθανώς να οδηγήσει σε ορθολογικότερη διαχείριση αυτών των ασθενών και ακριβέστερη εκτίμηση της πρόγνωσης.
Τα τελευταία χρόνια έχει συντελεστεί θεαματική πρόοδος στην αποκρυπτογράφηση του γενετικού υπόβαθρου του καρκίνου του θυρεοειδούς. Οι ευοίωνες μελλοντικές προοπτικές του μοριακού ελέγχου, θα συμπεριληφθούν στον κατάλογο του κλασικού προεγχειρητικού ελέγχου με σκοπό την διαστρωμάτωση του κινδύνου. Γενετικές αλλοιώσεις ανιχνεύονται σε ποσοστό 95% περίπου των όγκων. Οι μεταλλάξεις BRAF και RAS κατέχουν κομβικό ρόλο στην αιτιοπαθογένεια, ενώ οι μεταλλάξεις του επαγωγέα TERT και οι μεταλλάξεις ΤΡ53 ανιχνεύονται με υψηλή συχνότητα σε πιο προχωρημένους όγκους, που συχνά συνδέονται και με άλλες μεταλλάξεις. Η παρουσία τους είναι ένδειξη επιθετικής βιολογικής συμπεριφοράς των όγκων. Η ιστολογική εξέταση μαζί με τον μοριακό έλεγχο μπορεί να είναι προγνωστική για την πορεία του θυρεοειδικού καρκίνου. Μέχρι στιγμής η γονιδιακή ανάλυση έχει περιορισμένη χρηστικότητα στην συνολική θεραπευτική διαχείριση. Ωστόσο, η μοριακή παθολογία μπορεί να φανεί χρήσιμη για εξατομικευμένες, εκτός έγκρισης στοχευμένες θεραπείες, όταν δεν υπάρχουν αποδεικτικές κλινικές μελέτες.
Κλινική εικόνα
 περισσότεροι ασθενείς με καρκίνο θυρεοειδούς προσέρχονται με ψηλαφητή μάζα στον τράχηλο και συνήθως είναι ασυμπτωματικοί. Σε σπάνιες περιπτώσεις οι ασθενείς παρουσιάζονται με βράγχος φωνής, πόνο, δυσφαγία, δύσπνοια, βήχα ή αίσθημα πνιγμού. Ο πόνος που σχετίζεται με κακοήθη νόσο του θυρεοειδούς εγείρει την υποψία για μυελοειδές ή αμετάπλαστο καρκίνωμα ή λέμφωμα. Πρακτικά, όλοι οι ασθενείς με τραχηλική λεμφαδενοπάθεια που οφείλεται σε μεταστατικό καρκίνωμα έχουν σύστοιχο καρκίνο θυρεοειδούς, ενώ σε ποσοστό 20% η πρωτοπαθής εστία δεν είναι ψηλαφητή.
περισσότεροι ασθενείς με καρκίνο θυρεοειδούς προσέρχονται με ψηλαφητή μάζα στον τράχηλο και συνήθως είναι ασυμπτωματικοί. Σε σπάνιες περιπτώσεις οι ασθενείς παρουσιάζονται με βράγχος φωνής, πόνο, δυσφαγία, δύσπνοια, βήχα ή αίσθημα πνιγμού. Ο πόνος που σχετίζεται με κακοήθη νόσο του θυρεοειδούς εγείρει την υποψία για μυελοειδές ή αμετάπλαστο καρκίνωμα ή λέμφωμα. Πρακτικά, όλοι οι ασθενείς με τραχηλική λεμφαδενοπάθεια που οφείλεται σε μεταστατικό καρκίνωμα έχουν σύστοιχο καρκίνο θυρεοειδούς, ενώ σε ποσοστό 20% η πρωτοπαθής εστία δεν είναι ψηλαφητή.
Ο κλινικά εμφανής θυρεοειδικός καρκίνος είναι σχετικά σπάνιος, ενώ ο μη κλινικά εμφανής ή λανθάνων τύπος είναι συχνότερος. Ως λανθάνων καρκίνος ορίζεται κάθε κακοήθης βλάβη με μέγεθος <10 mm που ανευρίσκεται τυχαία μετά από θυρεοειδεκτομή ή νεκροτομή. Ο επιπολασμός του λανθάνοντος καρκίνου του θυρεοειδούς σε νεκροτομικές μελέτες ανέρχεται στο 3,67%.
Το ιστορικό και η φυσική εξέταση αποτελούν τον ακρογωνιαίο λίθο της αρχικής εκτίμησης των ασθενών με πιθανό καρκίνο θυρεοειδούς. Προδιαθεσικοί παράγοντες για ανάπτυξη κακοηθείας είναι το ιστορικό ακτινοβόλησης στην περιοχή της κεφαλής και του τραχήλου, η ολόσωμη ακτινοβόληση στα πλαίσια μεταμόσχευσης μυελού οστών, η έκθεση σε ραδιενεργό ακτινοβολία, όπως συνέβη στο πυρηνικό ατύχημα του Chernobyl το 1986 και το οικογενειακό ιστορικό καρκίνου του θυρεοειδούς. Παιδιά, άνδρες και άτομα ηλικίας >60 ετών διατρέχουν αυξημένο κίνδυνο κακοήθειας. Το ατομικό και οικογενειακό ιστορικό άλλων ενδοκρινικών διαταραχών, και ειδικότερα υπερπαραθυρεοειδισμού, αδενωμάτων υπόφυσης, όγκων νησιδίων παγκρέατος, όγκων επινεφριδίων και καρκίνου μαστού, συσχετίζονται με αυξημένο κίνδυνο εμφάνισης καρκίνου του θυρεοειδούς. Το οικογενειακό ιστορικό θηλώδους ή μυελοειδούς καρκινώματος (σύνδρομο ΜΕΝ), οικογενούς πολυποδίασης, συνδρόμου Gardner και συνδρόμου Cowden, ανήκουν επίσης στους προδιαθεσικούς παράγοντες κινδύνου για ανάπτυξη καρκίνου του θυρεοειδούς.
Οσάκις βρεθεί ψηλαφητός θυρεοειδικός όζος πραγματοποιείται επιμελής φυσική εξέταση, η οποία εστιάζεται κυρίως στο θυρεοειδή αδένα και στους τραχηλικούς λεμφαδένες. Στα κλινικά ευρήματα που εγείρουν υποψία για υποκείμενη κακοήθεια περιλαμβάνονται η ανώμαλη κοκκώδης μορφολογία του θυρεοειδικού όζου, η τραχηλική λεμφαδενοπάθεια, η πάρεση των φωνητικών χορδών και η καθήλωση του όζου σε γειτονικές ανατομικές δομές. Οι ασθενείς με βράγχος φωνής υποβάλλονται σε άμεση λαρυγγοσκόπηση για τον έλεγχο της κινητικότητας των φωνητικών χορδών.
Διάγνωση
 Η εργαστηριακή διάγνωση και παρακολούθηση του θυρεοειδικού καρκίνου αποτελούν ένα ταχέως εξελισσόμενο πεδίο, καθώς όλο και πιο ειδικές και εξεζητημένες απεικονιστικές μέθοδοι, όπως το υπερηχογράφημα (US), η FNAB, ο γενετικός έλεγχος και οι καρκινικοί δείκτες διαδραματίζουν κορυφαίο ρόλο.
Η εργαστηριακή διάγνωση και παρακολούθηση του θυρεοειδικού καρκίνου αποτελούν ένα ταχέως εξελισσόμενο πεδίο, καθώς όλο και πιο ειδικές και εξεζητημένες απεικονιστικές μέθοδοι, όπως το υπερηχογράφημα (US), η FNAB, ο γενετικός έλεγχος και οι καρκινικοί δείκτες διαδραματίζουν κορυφαίο ρόλο.
Στην πρώτη γραμμή της διάγνωσης και της μετεγχειρητικής παρακολούθησης βρίσκεται το υπερηχογράφημα (US), με το οποίο εκτιμάται τόσο η έκταση της νόσου όσο και οι υποτροπές. Το υπερηχογράφημα υψηλής ευκρίνειας του θυρεοειδούς αποτελεί το επόμενο βήμα μετά την φυσική εξέταση για την αξιολόγηση των ασθενών. Με τους σύγχρονους υπερηχογράφους υψηλής συχνότητας, μεταξύ 10 και 13 MHz, ανιχνεύονται όζοι μεγέθους >2 mm. Με την εξέλιξη της τεχνολογίας, η αρχική υπόθεση ότι θυρεοειδικοί όζοι υπάρχουν σε ποσοστό >50% σε άτομα ηλικίας >50 ετών έχει πλέον επιβεβαιωθεί. Τα υπερηχογραφικά ευρήματα που συνηγορούν για κακοήθεια είναι: α) τα ανώμαλα όρια, β) η αυξημένη αγγείωση του όζου και γ) οι μικροαποτιτανώσεις.
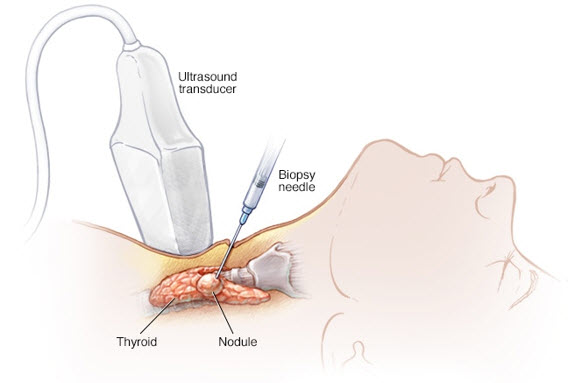 Η FNAB αποτελεί την πιο αξιόπιστη και αποδοτική μέθοδο για την αξιολόγηση των θυρεοειδικών όζων. Αυτή πραγματοποιείται συστηματικά υπό US καθοδήγηση σε μικρούς όζους ή όζους που δύσκολα ψηλαφώνται ή σε σύμπλεγμα όζων, με στόχο την μείωση των ποσοστών αποτυχίας. Με την βοήθεια του US, η FNAB των πιο ύποπτων και όχι κατ’ ανάγκη των πιο μεγάλων όζων, έχει την υψηλότερη προγνωστική αξία στην ανίχνευση κακοηθείας. Η διαγνωστική ευαισθησία της FNAB είναι μικρή σε ασθενείς με κακοήθεια, που αναπτύχθηκε μετά από ακτινοβόληση του θυρεοειδούς ή σε περιπτώσεις οικογενούς καρκίνου. Αυτοί οι ασθενείς πρέπει να υποβάλλονται σε χειρουργική επέμβαση με πιο ελαστικά κριτήρια, οσάκις υπάρχει κλινική υποψία για κακοήθεια.
Η FNAB αποτελεί την πιο αξιόπιστη και αποδοτική μέθοδο για την αξιολόγηση των θυρεοειδικών όζων. Αυτή πραγματοποιείται συστηματικά υπό US καθοδήγηση σε μικρούς όζους ή όζους που δύσκολα ψηλαφώνται ή σε σύμπλεγμα όζων, με στόχο την μείωση των ποσοστών αποτυχίας. Με την βοήθεια του US, η FNAB των πιο ύποπτων και όχι κατ’ ανάγκη των πιο μεγάλων όζων, έχει την υψηλότερη προγνωστική αξία στην ανίχνευση κακοηθείας. Η διαγνωστική ευαισθησία της FNAB είναι μικρή σε ασθενείς με κακοήθεια, που αναπτύχθηκε μετά από ακτινοβόληση του θυρεοειδούς ή σε περιπτώσεις οικογενούς καρκίνου. Αυτοί οι ασθενείς πρέπει να υποβάλλονται σε χειρουργική επέμβαση με πιο ελαστικά κριτήρια, οσάκις υπάρχει κλινική υποψία για κακοήθεια.
Οι καρκινικοί δείκτες, δηλαδή η θυρεοσφαιρίνη για τα καλώς διαφοροποιημένα καρκινώματα και η καλσιτονίνη και το καρκινοεμβρυϊκό αντιγόνο για το μυελοειδές καρκίνωμα, είναι επίσης πολύτιμοι δείκτες στην διερεύνηση υπολειμματικής ή υποτροπιάζουσας νεοπλασματικής νόσου.
Προεγχειρητικά, οι ασθενείς θα πρέπει να υποβάλλονται σε υπερηχογραφικό έλεγχο του θυρεοειδούς και των τραχηλικών λεμφαδένων, καθώς επίσης και στις απαραίτητες λειτουργικές δοκιμασίες. Όταν υπάρχει ισχυρή υποψία ή σαφείς ενδείξεις καλά διαφοροποιημένου καρκίνου του θυρεοειδούς μετά από μέτρηση της θυρεοσφαιρίνης, θα πρέπει να ελέγχονται και τα επίπεδα αντιθυρεοσφαιρινικών αντισωμάτων και ασβεστίου στο αίμα. Στην περίπτωση μυελοειδούς καρκινώματος μετρούνται τα επίπεδα της καλσιτονίνης στον ορό του αίματος, τα επίπεδα ασβεστίου και το καρκινοεμβρυϊκό αντιγόνο. Όλοι οι ασθενείς με μυελοειδές καρκίνωμα ελέγχονται για το πρωτοογκογονίδιο RET και εξετάζονται προεγχειρητικά στοχευμένα για την πιθανότητα συνύπαρξης φαιοχρωμοκυττώματος και υπερπαραθυρεοειδισμού, στο πλαίσιο του συνδρόμου της πολλαπλής ενδοκρινικής νεοπλασίας (ΜΕΝ).
ΤΝΜ σταδιοποίηση όγκων θυρεοειδούς
Τ: Όγκος
ΤΧ Άγνωστο μέγεθος όγκου, αλλά χωρίς εξωθυρεοειδική εντόπιση
ΤΟ Δεν υπάρχει ένδειξη πρωτοπαθούς όγκου
ΤΙ Όγκος διαμέτρου < 2 cm περιορισμένος στο θυρεοειδή
Τ2 Όγκος διαμέτρου 2-4 cm περιορισμένος στο θυρεοειδή
Τ3 Όγκος διαμέτρου >4 cm περιορισμένος στο θυρεοειδή ή με μικρή εξωθυρεοειδική επέκταση
Τ4α Όγκος οποιουδήποτε μεγέθους, που επεκτείνεται πέραν της θυρεοειδικής κάψας και διηθεί το υποδόριο, το λάρυγγα, την τραχεία, τον οισοφάγο ή το παλίνδρομο λαρυγγικό νεύρο ή ενδοθυρεοειδικός αμετάπλαστος όγκος.
T4β Όγκος που διηθεί την προσπονδυλική περιτονία ή ενθυλακώνει την καρωτίδα ή τα αγγεία του μεσοθωρακίου ή εξωθυρεοειδικός αμετάπλαστος όγκος.
Ν: Λεμφαδένες
NX Δεν έχει γίνει εκτίμηση των λεμφαδένων
NO Χωρίς διήθηση λεμφαδένων
N1α Διήθηση των λεμφαδένων επιπέδου IV (προτραχειακοί, παρατραχειακοί και προλαρυγγικοί/δελφικοί λεμφαδένες]
N1β Διήθηση σύστοιχων, αμφοτερόπλευρων ή ετερόπλευρων τραχηλικών ή μεσοθωρακικών λεμφαδένων
Μ: Μεταστάσεις
MX Δεν έχει προσδιορισθεί η ύπαρξη μεταστάσεων
MO Χωρίς απομακρυσμένες μεταστάσεις
M1 Απομακρυσμένες μεταστάσεις
Στάδια
Στάδιο I Τ1, NO, Μ0
Στάδιο II Τ2, NO, Μ0
Στάδιο III Τ3, NO, Μ0
T1,N1α,M0
Τ2, Ν1α,Μ0
Τ3, Ν1α,ΜΟ
Στάδιο IVα Τ4α,NO,Μ0
Τ4α,Ν1α, Μ0
Τ1, N1β, Μ0
T2, N1β, M0
T3,N1β,M0
T4α,N1β,M0
Στάδιο IVβ T4βb, οποιοδήποτε Ν, M0
Στάδιο IVγ Οποιοδήποτε Τ,Ν,M1
Θηλώδες καρκίνωμα θυρεοειδούς
 Το θηλώδες καρκίνωμα του θυρεοειδούς (Papillary Thyroid Cancer / PTC) αποτελεί την πιο συχνή κακοήθεια των ενδοκρινών αδένων και αντιστοιχεί στο 70% επί του συνόλου των κακοηθειών του θυρεοειδούς στις περιοχές που είναι επαρκείς σε ιώδιο. Είναι, επίσης, ο επικρατέστερος καρκίνος του θυρεοειδούς στα παιδιά. Το θηλώδες καρκίνωμα είναι τρεις φορές συχνότερος στις γυναίκες σε σχέση με τους άνδρες και εμφανίζει την μεγαλύτερη συχνότητα σε ηλικίες μεταξύ 38 και 45 ετών. Επίσης, αντιστοιχεί στο 90% των καρκινωμάτων που οφείλονται σε ακτινοβολία, ενώ είναι οικογενές στο 5% των περιπτώσεων.
Το θηλώδες καρκίνωμα του θυρεοειδούς (Papillary Thyroid Cancer / PTC) αποτελεί την πιο συχνή κακοήθεια των ενδοκρινών αδένων και αντιστοιχεί στο 70% επί του συνόλου των κακοηθειών του θυρεοειδούς στις περιοχές που είναι επαρκείς σε ιώδιο. Είναι, επίσης, ο επικρατέστερος καρκίνος του θυρεοειδούς στα παιδιά. Το θηλώδες καρκίνωμα είναι τρεις φορές συχνότερος στις γυναίκες σε σχέση με τους άνδρες και εμφανίζει την μεγαλύτερη συχνότητα σε ηλικίες μεταξύ 38 και 45 ετών. Επίσης, αντιστοιχεί στο 90% των καρκινωμάτων που οφείλονται σε ακτινοβολία, ενώ είναι οικογενές στο 5% των περιπτώσεων.
Ο όγκος εμφανίζεται συνήθως νωρίς στην ενήλικη ζωή και εκδηλώνεται ως μονήρης όζος. Δίνει συχνά λεμφαδενικές μεταστάσεις στον τράχηλο κατά μήκος του συστοίχου στερνοκλειδομαστοειδούς μυός και στον υπερκλείδιο βόθρο. Ενδέχεται ο πρωτοπαθής όγκος να είναι αψηλάφητος και ψηλαφώνται μόνο οι λεμφαδενικές μεταστάσεις στον τράχηλο. Ποσοστό 50% των παιδιών και 20% των ενηλίκων με PTC) πρωτοεμφανίζονται με ψηλαφητούς λεμφαδένες. Κύριοχαρακτηριστικό του είναι η πολυεστιακή εντόπιση, η οποία εμφανίζεται σε ποσοστό >30% των ασθενών. Σπανίως, ο όγκος μπορεί να δώσει απομακρυσμένες μεταστάσεις (3%) και συνήθως μεθίσταται στους πνεύμονες και στα οστά. Ο ρυθμός αύξησης του όγκου είναι πολύ βραδύς και επιταχύνεται από την TSH. Σημαντικό για την θεραπεία του είναι το γεγονός ότι στο 70% των περιστατικών προσλαμβάνει ραδιενεργό ιώδιο.
Η θεραπεία των PTC είναι παρεμφερής με εκείνη που γίνεται στα θυλακιώδη, αλλά με μικρότερη έμφαση στην ακτινοβολία και μεγαλύτερη στην ορμονοθεραπεία με θυροξίνη.
Παθολογοανατομία
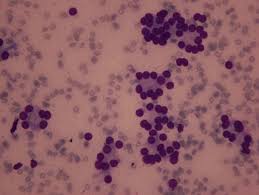 Το θηλώδες καρκίνωμα του θυρεοειδούς αναπτύσσεται από τα επιθηλιακά κύτταρα των θυλακίων και η ιστολογική διάγνωση τίθεται με βάση τα ειδικά κυτταρολογικά χαρακτηριστικά. Ιστολογικά, τα PTC επιδεικνύουν θηλώδεις προβολές του κυλινδρικού επιθηλίου, ένα μικτό πρότυπο θηλώδους και θυλακιώδους δομής. Τα κύτταρα είναι κυβοειδή με ωχρό, αδρό κυτταρόπλασμα, κυτταρική αυλάκωση, πολλούς πυρήνες και ενδοπυρηνικά έγκλειστα, που επιτρέπουν την διάγνωση του PTCκατά την εξέταση των κυτταρικών στοιχείων που περιέχονται στην βιοψία με FNA. Επιπλέον, η ανεύρεση επασβεστώσεων, γνωστές ως ψαμμώδη σωμάτια, συνεπικουρεί στην διάγνωση του PTC.
Το θηλώδες καρκίνωμα του θυρεοειδούς αναπτύσσεται από τα επιθηλιακά κύτταρα των θυλακίων και η ιστολογική διάγνωση τίθεται με βάση τα ειδικά κυτταρολογικά χαρακτηριστικά. Ιστολογικά, τα PTC επιδεικνύουν θηλώδεις προβολές του κυλινδρικού επιθηλίου, ένα μικτό πρότυπο θηλώδους και θυλακιώδους δομής. Τα κύτταρα είναι κυβοειδή με ωχρό, αδρό κυτταρόπλασμα, κυτταρική αυλάκωση, πολλούς πυρήνες και ενδοπυρηνικά έγκλειστα, που επιτρέπουν την διάγνωση του PTCκατά την εξέταση των κυτταρικών στοιχείων που περιέχονται στην βιοψία με FNA. Επιπλέον, η ανεύρεση επασβεστώσεων, γνωστές ως ψαμμώδη σωμάτια, συνεπικουρεί στην διάγνωση του PTC.
Σπάνια είναι αμιγή θηλώδη, οπότε ιστολογικά εμφανίζονται μόνο θηλοειδείς σχηματισμοί. Συνήθως όμως είναι μικτού τύπου με θυλακιώδη και θηλώδη στοιχεία. Επειδή τα μικτά καρκινώματα βιολογικά συμπεριφέρονται περισσότερο σαν θηλώδη, κατατάσσονται στα θηλώδη.
Οι άλλες υποκατηγορίες του PTC είναι πιο απρόβλεπτες και επιθετικές στην βιολογική συμπεριφορά. Τα νησιδιακά, τα κυλινδρικά, το διάχυτα σκληρωτικό, με διαυγή κύτταρα, το δικτυωτό και τους φτωχά διαφοροποιημένους τύπους αντιπροσωπεύουν αυτές τις μορφές του PTC. Αν και αυτές οι υποκατηγορίες είναι σπάνιες, εμφανίζονται συνηθέστερα σε ηλικιωμένους ασθενείς και η πρόγνωση είναι χειρότερη. Αυτές οι τελευταίες ομάδες αντιπροσωπεύουν λιγότερο από το 1% όλων των PTC.
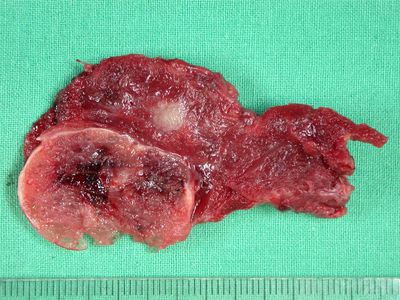 Η πολυεστιακότητα είναι συχνή στα PTC και διαπιστώνεται σε ποσοστό >85% των ασθενών κατά την ιστολογική μελέτη του χειρουργικού παρασκευάσματος μετά από ολική θυρεοειδεκτομή. Η πολυεστιακότητα συνοδεύεται από αυξημένη επίπτωση τραχηλικών λεμφαδενικών μεταστάσεων. Οι όγκοι αυτοί σπανίως ενδέχεται διηθήσουν γειτονικές ανατομικές δομές όπως είναι η τραχεία, ο οισοφάγος και τα παλίνδρομα λαρυγγικά νεύρα.
Η πολυεστιακότητα είναι συχνή στα PTC και διαπιστώνεται σε ποσοστό >85% των ασθενών κατά την ιστολογική μελέτη του χειρουργικού παρασκευάσματος μετά από ολική θυρεοειδεκτομή. Η πολυεστιακότητα συνοδεύεται από αυξημένη επίπτωση τραχηλικών λεμφαδενικών μεταστάσεων. Οι όγκοι αυτοί σπανίως ενδέχεται διηθήσουν γειτονικές ανατομικές δομές όπως είναι η τραχεία, ο οισοφάγος και τα παλίνδρομα λαρυγγικά νεύρα.
Από μακροσκοπική άποψη διακρίνομε τρεις τύπους PTC, ήτοι: α) το μικροκαρκίνωμα, β) τον ενδοθυρεοειδικό τύπο και γ) τον εξωθυρεοειδικό τύπο και ο καθένας ξεχωρίζει από το μέγεθος και την έκταση της πρωτοπαθούς νόσου.
Ως μικροκαρκίνωμα θεωρείται ο PTC που είναι <1cm, χωρίς διήθηση της θυρεοειδικής κάψας ή των αγγείων και δεν ανιχνεύονται λεμφαδενικές μεταστάσεις. Επονομάζεται και ως λανθάνων ή κρυφός όγκος. Δεν ψηλαφάται και συνήθως είναι τυχαίο εύρημα κατά την ιστολογική εξέταση του χειρουργικού παρασκευάσματος μετά από θυρεοειδεκτομή, η οποία γίνεται για άλλη αιτία. Μπορεί να έχει πολυεστιακή εντόπιση και κλινικά είναι αθόρυβος. Αν και είναι κακοήθης νόσος, η καλή βιολογική συμπεριφορά και η ευνοϊκή διαχρονική του εξέλιξη τον χαρακτηρίζουν ως καλοήθη. Αν βρεθεί τυχαία σε μια λοβεκτομή, που γίνεται για άλλη αιτία δεν χρειάζεται να γίνει κάτι περισσότερο. Αν πάλι έχει γίνει η διάγνωση από πριν, πράγμα σπάνιο λόγω του μικρού του μεγέθους, και πάλι δεν χρειάζεται συμπληρωματική θεραπεία. Περίπου το 70% αυτών των όγκων δεν αυξάνει αξιόλογα σε μέγεθος για μεγάλο χρονικό διάστημα. Είναι όμως πιθανό, αλλά εξαιρετικά σπάνιο, να βρεθεί τραχηλικός λεμφαδένας διηθημένος με θηλώδη καρκινικά κύτταρα, χωρίς να υπάρχει εμφανές κλινικό εύρημα στον θυρεοειδή αδένα. Στην περίπτωση αυτή η ολική θυρεοειδεκτομή θα αποκαλύψει σε κάποιο σημείο μια μικροσκοπική εντόπιση της πρωτοπαθούς καρκινικής εστίας.
Οι ενδοθυρεοειδικοί όγκοι περιορίζονται στον θυρεοειδή αδένα, χωρίς ένδειξη εξωθυρεοειδικής επέκτασης. Οι εξωθυρεοειδικοί όγκοι διηθούν την θυρεοειδική κάψα ή τις παρακείμενες ανατομικές δομές. Όλοι οι τύποι των PTC μπορεί να δώσουν περιοχικές λεμφαδενικές μεταστάσεις και να διηθήσουν τα ενδοαδενικά αιμοφόρα αγγεία ή περιστασιακά μακρινές μεταστάσεις. Η μακράς διαρκείας καλή πρόγνωση είναι εμφανέστερη στους ασθενείς με ενδοθυρεοειδικά καρκινώματα.
Κλινική εικόνα – Διάγνωση
 Ο PTC μπορεί να αποτελεί τυχαίο εύρημα σε δείγμα θυρεοειδικού ιστού που αφαιρέθηκε για καλοήθη πάθηση Αυτά τα καρκινώματα είναι τελείως ασυμπτωματικά, έχουν μέγεθος <5mm και σχεδόν ποτέ δεν παρουσιάζουν περιοχικές ή μακρινές μεταστάσεις. Η αντιμετώπιση από ογκολογική άποψη θεωρείται επαρκής εάν η βλάβη αυτή περιλαμβάνεται μέσα σε μια λοβεκτομή με ή χωρίς ισθμεκτομή.
Ο PTC μπορεί να αποτελεί τυχαίο εύρημα σε δείγμα θυρεοειδικού ιστού που αφαιρέθηκε για καλοήθη πάθηση Αυτά τα καρκινώματα είναι τελείως ασυμπτωματικά, έχουν μέγεθος <5mm και σχεδόν ποτέ δεν παρουσιάζουν περιοχικές ή μακρινές μεταστάσεις. Η αντιμετώπιση από ογκολογική άποψη θεωρείται επαρκής εάν η βλάβη αυτή περιλαμβάνεται μέσα σε μια λοβεκτομή με ή χωρίς ισθμεκτομή.
Η ανάδειξη μιας ψηλαφητής μάζας μεγέθους 1-2 εκατοστών εμβάλλει σε ισχυρή υποψία νεοπλάσματος. Επί υποψίας καρκίνου του θυρεοειδούς γίνεται επιμελής φυσική εξέταση του ασθενούς και λεπτομερής ανασκόπηση του ιατρικού ιστορικού. Οι περισσότεροι ασθενείς είναι ευθυρεοειδικοί και εμφανίζουν μια βραδέως αυξανόμενη ανώδυνη μάζα στον τράχηλο. Η δυσφαγία, η δύσπνοια και η δυσφωνία συνήθως είναι δηλωτικά τοπικά προχωρημένης νόσου με διήθηση των γειτονικών ανατομικών δομών κατά συνέχεια ιστού. Η διαγνωστική προσέγγιση ολοκληρώνεται με το υπερηχογράφημα, το οποίο αποφαίνεται για την πολυεστιακότητα της βλάβης και διακρίνει αν η μάζα είναι συμπαγής ή κυστική. Η FNAΒ υπό υπερηχογραφική καθοδήγηση της ψηλαφητής συμπαγούς μάζας είναι το επόμενο στάδιο. Το PTC μπορεί να ταυτοποιηθεί ιστολογικά με την FNAΒ, καθώς τα ειδικά κυτταρολογικά ευρήματα επιτρέπουν την ασφαλή διάγνωση. Πολυεστιακότητα της βλάβης ανευρίσκεται σε ποσοστό 70% των ασθενών με PTC.
 Επιπλέον, δεν θα πρέπει να αγνοηθεί το ενδεχόμενο της ύπαρξης τραχηλικών ή απομακρυσμένων μεταστάσεων. Οι λεμφαδενικές μεταστάσεις είναι συνήθεις στα παιδιά και στους νέους ενήλικες. Η ψηλάφηση παθολογικών λεμφαδένων της περιοχής ακολουθιέται πάντοτε από FNAΒ της ύποπτης βλάβης. Η ανεύρεση λεμφαδενικών μεταστάσεων στους ασθενείς με εξ ολοκλήρου ενδοθυρεοειδικό PTC δεν έχει σημαντικές επιπτώσεις στην τελική έκβαση και συνολική επιβίωση. Εάν η τελική παθολογοανατομική εξέταση δείξει διήθηση της κάψας του θυρεοειδούς ή και των αγγείων από το PTC, τότε υπάρχει υψηλό ποσοστό λεμφαδενικών μεταστάσεων και η πρόγνωση είναι δυσμενέστερη. Οι μακρινές μεταστάσεις είναι ασυνήθεις κατά την αρχική παρουσίαση, αλλά τελικά μπορεί να εμφανιστούν σε ασθενείς ηλικίας >20 ετών. Οι πιο συχνές εναποθέσεις γίνονται στους πνεύμονες και ακολουθούν τα οστά, το ήπαρ και ο εγκέφαλος.
Επιπλέον, δεν θα πρέπει να αγνοηθεί το ενδεχόμενο της ύπαρξης τραχηλικών ή απομακρυσμένων μεταστάσεων. Οι λεμφαδενικές μεταστάσεις είναι συνήθεις στα παιδιά και στους νέους ενήλικες. Η ψηλάφηση παθολογικών λεμφαδένων της περιοχής ακολουθιέται πάντοτε από FNAΒ της ύποπτης βλάβης. Η ανεύρεση λεμφαδενικών μεταστάσεων στους ασθενείς με εξ ολοκλήρου ενδοθυρεοειδικό PTC δεν έχει σημαντικές επιπτώσεις στην τελική έκβαση και συνολική επιβίωση. Εάν η τελική παθολογοανατομική εξέταση δείξει διήθηση της κάψας του θυρεοειδούς ή και των αγγείων από το PTC, τότε υπάρχει υψηλό ποσοστό λεμφαδενικών μεταστάσεων και η πρόγνωση είναι δυσμενέστερη. Οι μακρινές μεταστάσεις είναι ασυνήθεις κατά την αρχική παρουσίαση, αλλά τελικά μπορεί να εμφανιστούν σε ασθενείς ηλικίας >20 ετών. Οι πιο συχνές εναποθέσεις γίνονται στους πνεύμονες και ακολουθούν τα οστά, το ήπαρ και ο εγκέφαλος.
Προγνωστικοί δείκτες
Τα θηλώδη καρκινώματα, συμπεριλαμβανομένων των μεικτών θηλωδών-θυλακιωδών καρκινωμάτων, της θυλακιώδους παραλλαγής του θηλώδους καρκινώματος και του διάχυτου σκληρυντικού θηλώδους καρκινώματος, χαρακτηρίζονται από καλή πρόγνωση, με ποσοστό 10ετούς επιβίωσης >95%. Είναι αξιοσημείωτο ότι οι ασθενείς με PTC και ειδικά τα νέα άτομα, έχουν καλή πρόγνωση, μολονότι οι όγκοι αυτοί είναι πολυεστιακοί σε ποσοστό >30% και συνοδεύονται με λεμφαδενικές μεταστάσεις στο 80% των περιπτώσεων.
Έχουν χρησιμοποιηθεί αρκετοί προγνωστικοί δείκτες από τα διάφορα συστήματα σταδιοποίησης με σκοπό την κατάταξη των ασθενών σε ομάδες χαμηλού και υψηλού κινδύνου. Η απουσία απομακρυσμένης μετάστασης κατά την αρχική διάγνωση και το μέγεθος του όγκου <4 cm είναι οι πιο σπουδαίοι θετικοί παράγοντες. Το μέγεθος του όγκου >4 cm και η διήθηση της κάψας ή και των αγγείων περιορίζουν το προσδόκιμο επιβίωσης και επιδεινώνουν την θνητότητα.
Δυστυχώς, όλα αυτά τα συστήματα ταξινόμησης βασίζονται σε μετεγχειρητικά ευρήματα, τα οποία δεν είναι διαθέσιμα προεγχειρητικά. Το σύστημα βαθμολόγησης AGES ενσωματώνει την ηλικία, τον ιστολογικό βαθμό διαφοροποίησης, την εξωθυρεοειδική διήθηση, τις μεταστάσεις και το μέγεθος του όγκου για να προβλέψει τον κίνδυνο θανάτου από θηλώδη καρκίνο. Οι χαμηλού κινδύνου ασθενείς είναι νέοι, με καλά διαφοροποιημένους όγκους, χωρίς μεταστάσεις και μικρές πρωτοπαθείς βλάβες, ενώ οι υψηλού κινδύνου ασθενείς είναι πιο ηλικιωμένοι, με φτωχά διαφοροποιημένους όγκους, τοπική διήθηση, μακρινές μεταστάσεις και μεγάλες πρωτοπαθείς βλάβες. Η κλίμακα MACIS είναι ένα πιο πολύπλοκο μετεγχειρητικό σύστημα, το οποίο αποτελεί τροποποίηση της κλίμακας AGES. Αυτή η κλίμακα ενσωματώνει τις μακρινές μεταστάσεις, την ηλικία κατά την παρουσίαση, την ριζικότητα της αρχικής χειρουργικής αφαίρεσης, την εξωθυρεοειδική διήθηση και το μέγεθος της αρχικής βλάβης (σε εκατοστά) και ταξινομεί τους ασθενείς σε τέσσερις ομάδες κινδύνου βάσει της βαθμολογίας τους. Το σύστημα AMES ταξινομεί τους διαφοροποιημένους καρκίνους του θυρεοειδούς σε ομάδες χαμηλού και υψηλού κινδύνου με κριτήρια την ηλικία (άνδρες < 40 ετών, γυναίκες <50 ετών), τις μεταστάσεις, την εξωθυρεοειδική επέκταση και το μέγεθος των όγκων (< ή > των 5cm). Ένα άλλο σύστημα ταξινόμησης είναι το σύστημα ΤΝΜ, (όγκος, κατάσταση λεμφαδένων, μεταστάσεις, που χρησιμοποιείται από τα περισσότερα ιατρικά κέντρα του κόσμου. Ένα απλοποιημένο σύστημα από τον DeGroot χρησιμοποιεί τέσσερις ομάδες: τάξη Ι (ενδοθυρεοειδικός), τάξη ΙΙ (αυχενικές λεμφαδενικές μεταστάσεις), τάξη ΙΙΙ (εξωθυρεοειδική διήθηση) και τάξη ΙV (μακρινές μεταστάσεις) για να προβλέψει την πρόγνωση.
Πάντως, τα συστήματα αυτά είναι χρήσιμα στην πρόβλεψη της βιολογικής συμπεριφοράς του όγκου, επειδή η πιθανότητα θανάτου από καρκίνωμα θυρεοειδούς στην ομάδα χαμηλού κινδύνου είναι μόλις 5%, ενώ στην ομάδα υψηλού κινδύνου πλησιάζει το 40%. Ευτυχώς, οι περισσότεροι ασθενείς με PTC (70%) ανήκουν στην ομάδα χαμηλού κινδύνου. Άλλοι μοριακοί και γενετικοί δείκτες που προβλέπουν την βιολογική συμπεριφορά του όγκου είναι: 1) η ανευπλοειδία, 2) η ανταπόκριση της αδενυλικής κυκλάσης στην TSH, 3) η πρόσληψη του ραδιενεργού ιωδίου, 4) η εξέταση PET και 5) τα επίπεδα του υποδοχέα του επιδερμικού αυξητικού παράγοντα (EGF), καθώς και διάφοροι συνδυασμοί έκφρασης άλλων γονιδίων (μεταλλάξεις ΤΡ53, N-RAS και gsp, υπερέκφραση του c-myc).
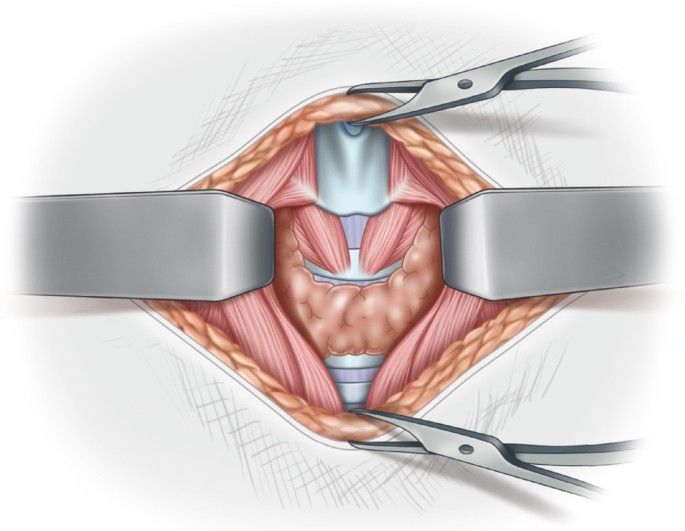
Χειρουργική θεραπεία του PTC
Η θεραπεία του PTC κατά βάση είναι χειρουργική. Πριν την χειρουργική επέμβαση απαιτείται εξονυχιστικός προεγχειρητικός έλεγχος, ο οποίος περιλαμβάνει τις ακόλουθες εξετάσεις:
- Μέτρηση θυρεοσφαιρίνης
- Υπερηχογράφημα υψηλής ευκρίνειας
- Αξονική τομογραφία, MRI, PET
- Βιοψία με παρακέντηση με λεπτή βελόνα (FNAΒ)
- Έλεγχος των λαρυγγικών νεύρων με λαρυγγοσκόπηση
- Μέτρηση ασβεστίου αίματος
 Ο τύπος της χειρουργικής επέμβασης, εάν δηλαδή γίνει λοβεκτομή με ή χωρίς ισθμεκτομή, ολική ή σχεδόν ολική ή υφολική θυρεοειδεκτομή, με ή χωρίς λεμφαδενικό καθαρισμό, αποφασίζεται με συγκεκριμένα κριτήρια όπως το μέγεθος, τα χαρακτηριστικά του όγκου και το στάδιο της νόσου. Ωστόσο, ποικίλοι άλλοι παράγοντες υπεισέρχονται στην τελική διαμόρφωση της χειρουργικής απόφασης. Οι νέοι ασθενείς με PTC και ιδιαίτερα εκείνοι με ηλικία <15 ετών, εμφανίζουν υψηλό ποσοστό λεμφαδενικών μεταστάσεων (90%) και επομένως θα πρέπει να υποβάλλονται σε ολική θυρεοειδεκτομή με λεμφαδενικό καθαρισμό, ειδικά όταν υπάρχουν ψηλαφητοί τραχηλικοί λεμφαδένες. Επιπλέον, στους πιο ηλικιωμένους ασθενείς με ιστορικό ακτινοβολίας στον τράχηλο υιοθετείται επιθετικότερη στρατηγική, η οποία περιλαμβάνει την ολική θυρεοειδεκτομή και τον λεμφαδενικό καθαρισμό επί παρουσίας εμφανώς διηθημένων τραχηλικών λεμφαδένων.
Ο τύπος της χειρουργικής επέμβασης, εάν δηλαδή γίνει λοβεκτομή με ή χωρίς ισθμεκτομή, ολική ή σχεδόν ολική ή υφολική θυρεοειδεκτομή, με ή χωρίς λεμφαδενικό καθαρισμό, αποφασίζεται με συγκεκριμένα κριτήρια όπως το μέγεθος, τα χαρακτηριστικά του όγκου και το στάδιο της νόσου. Ωστόσο, ποικίλοι άλλοι παράγοντες υπεισέρχονται στην τελική διαμόρφωση της χειρουργικής απόφασης. Οι νέοι ασθενείς με PTC και ιδιαίτερα εκείνοι με ηλικία <15 ετών, εμφανίζουν υψηλό ποσοστό λεμφαδενικών μεταστάσεων (90%) και επομένως θα πρέπει να υποβάλλονται σε ολική θυρεοειδεκτομή με λεμφαδενικό καθαρισμό, ειδικά όταν υπάρχουν ψηλαφητοί τραχηλικοί λεμφαδένες. Επιπλέον, στους πιο ηλικιωμένους ασθενείς με ιστορικό ακτινοβολίας στον τράχηλο υιοθετείται επιθετικότερη στρατηγική, η οποία περιλαμβάνει την ολική θυρεοειδεκτομή και τον λεμφαδενικό καθαρισμό επί παρουσίας εμφανώς διηθημένων τραχηλικών λεμφαδένων.
Ο αποκλεισμός της πολυεστιακότητας της νόσου στο θυρεοειδικό παρέγχυμα και ο έλεγχος των τραχηλικών λεμφαδένων για μετάσταση πραγματοποιείται πρωτίστως με το υπερηχογράφημα υψηλής ευκρίνειας και δευτερευόντως με την αξονική τομογραφία τραχήλου Ο έλεγχος για πιθανές απομακρυσμένες μεταστάσεις περιλαμβάνει την ακτινογραφία θώρακος και άλλες απεικονιστικές εξετάσεις ανάλογα με τον βαθμό της κλινικής υποψίας.
Σε PTC μεγέθους <1 cm οι συγγραφείς συμφωνούν ότι η λοβεκτομή με ισθμεκτομή συνιστά επαρκή χειρουργική θεραπεία. Αυτό ισχύει περισσότερο για τα PTC που ανακαλύπτονται τυχαία. Η επανεπέμβαση με σκοπό την συμπληρωματική ολική θυρεοειδεκτομή δεν συνιστάται, εκτός εάν ο όγκος είναι πολυεστιακός, υπάρχουν λεμφαδενικές μεταστάσεις ή διήθηση της θυρεοειδικής κάψας και των αγγείων. Οι υπέρμαχοι της λοβεκτομής με ισθμεκτομή ως τελεσίδικη θεραπεία στους ασθενείς χαμηλού κινδύνου, προτάσσουν τα χαμηλά ποσοστά υποτροπής στην κοίτη της εκτομής (5%) καθώς και το αυξημένο ποσοστό επιπλοκών μετά από ανώφελες εκτεταμένες επεμβάσεις.
Ο έκταση της θυρεοειδεκτομής για το προχωρημένο PTC (>1cm) παραμένει επίκαιρο θέμα επιστημονικών συζητήσεων μεταξύ των χειρουργών σε πλανητικό επίπεδο. Σε ασθενείς ηλικίας 15 – 40 ετών με βλάβες <2 cm, η επιλογή του τύπου της χειρουργικής επέμβασης είναι διφορούμενη. Η υφιστάμενη διαφωνία αφορά στην διενέργεια ολικής θυρεοειδεκτομής έναντι λοβεκτομής με ισθμεκτομή στους ενήλικες με PTC μεγέθους 1 – 2 cm. Μερικοί χειρουργοί πραγματοποιούν πάντοτε ολική θυρεοειδεκτομή σε κάθε ασθενή με PTC, επειδή το καρκίνωμα συχνά είναι πολυεστιακό. Ωστόσο, υπάρχουν πολλά επιστημονικά ερείσματα στην διεθνή βιβλιογραφία που υποστηρίζουν ότι η λοβεκτομή με ισθμεκτομή μπορούν να αποτελέσουν επαρκή θεραπεία σε ασθενείς που η βλάβη περιορίζεται μόνο στον έναν λοβό.
Στα πλεονεκτήματα της ολικής θυρεοειδεκτομής περιλαμβάνεται η αποτελεσματική μετεγχειρητική χρήση του ραδιενεργού ιωδίου, εφόσον ενδείκνυται. Είναι σαφές ότι, εάν υπάρχει υπολειμματικός θυρεοειδικός ιστός, το ραδιενεργό ιώδιο είναι λιγότερο αποτελεσματικό και απαιτείται μεγαλύτερη δόση. Τα πλεονεκτήματα της συντηρητικότερης χειρουργικής επέμβασης είναι τα μειωμένα ποσοστά της αμφοτερόπλευρης βλάβης των παλίνδρομων λαρυγγικών νεύρων και του κινδύνου του υποπαραθυρεοειδισμού.
Ο προβληματισμός γίνεται πιο πολύπλοκος, όταν ο χειρουργός αγνοώντας την πραγματική διάγνωση, πραγματοποιεί μόνο λοβεκτομή για ένα ψυχρό όζο και λίγες μέρες αργότερα διαπιστώνεται κακοήθεια από την κανονική ιστολογική εξέταση. Σε αυτές τις περιπτώσεις μερικοί συνιστούν επανεπέμβαση για να αφαιρεθεί και ο άλλος λοβός, ενώ οι περισσότεροι θεωρούν την λοβεκτομή επαρκή θεραπεία εάν ο άλλος λοβός στην εγχείρηση φαίνεται υγιής.
Σε ενήλικες ασθενείς με PTC >2 cm εφαρμόζεται πιο επιθετική χειρουργική θεραπεία. Στις περιπτώσεις αυτές η ολική ή η σχεδόν ολική θυρεοειδεκτομή υιοθετείται από την πλειονότητα των χειρουργών. Η ολική θυρεοειδεκτομή έχει ποσοστό επιπλοκών <2% όταν εκτελείται από χειρουργούς με εμπειρία και εξειδίκευση στο συγκεκριμένο χειρουργικό πεδίο, συνδέεται με λιγότερες υποτροπές και προσφέρει καλύτερη πρόγνωση.
Η ολική θυρεοειδεκτομή έχει τα ακόλουθα πλεονεκτήματα:
- Αφαιρείται πλήρως ο θυρεοειδικός ιστός, ελαχιστοποιείται η πιθανότητα τοπικής υποτροπής και το ενδεχόμενο της επανεγχείρησης είναι μικρό.
- Μετά από ολική θυρεοειδεκτομή η επικουρική θεραπεία με ραδιενεργό ιώδιο είναι πιο αποτελεσματική, γιατί αυτό προσλαμβάνεται εξ ολοκλήρου από τα μικροσκοπικά υπολείμματα του θυρεοειδικού ιστού, από τους διηθημένους λεμφαδένες και τις μακρινές μεταστατικές εστίες. Αντίθετα, μετά από υφολική θυρεοειδεκτομή ή λοβεκτομή, το ιώδιο προσλαμβάνεται κυρίως από τον εναπομείναντα θυρεοειδικό ιστό.
- Τα επίπεδα θυρεοσφαιρίνης μετά την θυρεοειδεκτομή αποκτούν μεγαλύτερη διαγνωστική αξία στην ανίχνευση ενδεχόμενης υποτροπής ή υπολειμματικής νόσου.
- Συναφαιρείται λανθάνων πολυεστιακός ενδοθυρεοειδικός καρκίνος.
- Εξαλείφεται η πιθανότητα μετάπτωσης ενός διαφοροποιημένου καρκίνου σε αδιαφοροποίητο καρκίνωμα.
Η θεραπευτική αξία του λεμφαδενικού καθαρισμού στα θηλώδη καρκινώματα και η προγνωστική σημασία των λεμφαδενικών μεταστάσεων παραμένουν διφορούμενα ζητήματα. Οι μικρομεταστάσεις στους τραχηλικούς λεμφαδένες είναι συχνές στα θηλώδη καρκινώματα (>30%). Η καλή πορεία των περισσοτέρων από αυτές, καθιστά περιττό τον προφυλακτικό λεμφαδενικό καθαρισμό.
Το προεγχειρητικό υπερηχογράφημα υψηλής ευκρίνειας του τραχήλου, όταν χρησιμοποιείται ως εξέταση ρουτίνας, ανιχνεύει ευρήματα ενδεικτικά τραχηλικής λεμφαδενικής διασποράς της νόσου. Στους ασθενείς οποιασδήποτε ηλικίας στους οποίους υπάρχει εμφανής λεμφαδενοπάθεια, ο τροποποιημένος λεμφαδενικός καθαρισμός στην σύστοιχη της βλάβης πλευρά και η ολική θυρεοειδεκτομή αποτελούν την ενδεδειγμένη χειρουργική θεραπεία.
Όταν διεγχειρητικά διαπιστώνονται διογκωμένοι λεμφαδένες στην κεντρική ή στην πλάγια τραχηλική χώρα, αυτοί αφαιρούνται και αποστέλλονται για ταχεία βιοψία. Εφόσον είναι διηθημένοι, εκτελείται τροποποιημένος λεμφαδενικός καθαρισμός του τραχήλου. Ο λειτουργικός λεμφαδενικός καθαρισμός είναι προτιμότερος από την επιλεκτική αφαίρεση μεμονωμένων διογκωμένων λεμφαδένων, γιατί σχετίζεται με χαμηλότερα ποσοστά υποτροπής της νόσου. Επίσης, βοηθά στην μείωση των επανεπεμβάσεων για λεμφαδενικές υποτροπές, κάτι το οποίο είναι αρκετά δύσκολο σε μία ήδη χειρουργημένη περιοχή.
Ορισμένοι χειρουργοί εκτελούν συστηματικά κατά την αρχική επέμβαση κεντρικό λεμφαδενικό καθαρισμό, ανεξαρτήτως υπερηχογραφικών ευρημάτων, για να μειώσουν τον κίνδυνο υποτροπής της νόσου στην κεντρική τραχηλική χώρα. Απεναντίας, άλλοι ερευνητές θεωρούν ότι ο προφυλακτικός τροποποιημένος λεμφαδενικός καθαρισμός δεν είναι απαραίτητος στους ασθενείς με θηλώδη καρκίνο, παρά μόνο αφαιρούν τους ψηλαφητούς λεμφαδένες, όποτε αυτοί εμφανιστούν.
Προφυλακτικός λεμφαδενικός καθαρισμός (ΠΛΚ)
 Ο καλά διαφοροποιημένος καρκίνος θυρεοειδούς και ειδικά ο PTC χαρακτηρίζεται από εξαιρετικά καλή πρόγνωση. Τα ποσοστά της 5ετούς επιβίωσης προσεγγίζουν το 100% στην εντοπισμένη ενδοθυρεοειδή νόσο, είναι κοντά στο 98% για νόσο με διασπορά στους περιοχικούς λεμφαδένες και βρίσκεται στο 56% σε νόσο με απομακρυσμένες μεταστάσεις.
Ο καλά διαφοροποιημένος καρκίνος θυρεοειδούς και ειδικά ο PTC χαρακτηρίζεται από εξαιρετικά καλή πρόγνωση. Τα ποσοστά της 5ετούς επιβίωσης προσεγγίζουν το 100% στην εντοπισμένη ενδοθυρεοειδή νόσο, είναι κοντά στο 98% για νόσο με διασπορά στους περιοχικούς λεμφαδένες και βρίσκεται στο 56% σε νόσο με απομακρυσμένες μεταστάσεις.
Ο καλά διαφοροποιημένος καρκίνος του θυρεοειδούς από θυλακικά κύτταρα παρουσιάζει ένα συνήθη διαδοχικό πρότυπο μεταστατικής διασποράς, αρχικά στο κεντρικό τραχηλικό διαμέρισμα και ύστερα στα πλάγια τραχηλικά διαμερίσματα. Η λεμφαδενική διασπορά στα πλάγια τραχηλικά διαμερίσματα είναι συχνότερη στον θηλώδη και λιγότερα συχνή στον θυλακιώδη καρκίνο του θυρεοειδούς. Η κατανομή των λεμφαδενικών μεταστάσεων διαφοροποιείται στα επί μέρους λεμφαδενικά διαμερίσματα. Η λεμφαδενική διασπορά του θυρεοειδικού καρκίνου είναι αρκετά συχνή, με τα ποσοστά στην διεθνή βιβλιογραφία να ξεπερνούν το 50%. Σύμφωνα με κάποιες βιβλιογραφικές αναφορές η παρουσία μικροσκοπικής λεμφαδενικής μετάστασης πλησιάζει το 90%.
Η προεγχειρητική απεικονιστική εντόπιση παθολογικών ή ύποπτων λεμφαδένων στο κεντρικό τραχηλικό διαμέρισμα είναι τις περισσότερες φορές δύσκολη, επειδή τόσο το υπερηχογράφημα όσο και η αξονική τομογραφία έχουν περιορισμένη ευαισθησία και ειδικότητα. Συγκεκριμένα, το υπερηχογράφημα εμφανίζει ευαισθησία 55% και ειδικότητα 86%, ενώ οι αντίστοιχες τιμές για την αξονική τομογραφία είναι 67% και 85%. Τέλος το PET εμφανίζει ακόμα χαμηλότερη ευαισθησία με τιμές που δεν υπερβαίνουν το 40%. Γίνεται λοιπόν αντιληπτό ότι οι διαθέσιμες απεικονιστικές μέθοδοι δεν είναι η πλέον αξιόπιστη λύση για την ανάδειξη της λεμφαδενικής διασποράς στο κεντρικό τραχηλικό διαμέρισμα.
Η θεραπεία του PTC κατά βάση είναι χειρουργική και περιλαμβάνει την ολική θυρεοειδεκτομή με ή χωρίς λεμφαδενικό καθαρισμό, ανάλογα με την έκταση της νόσου όπως αυτή καθορίζεται από τα προεγχειρητικά και τα διεγχειρητικά ευρήματα. Ο προεγχειρητικός έλεγχος κατά κανόνα γίνεται με υψηλής ευκρίνειας υπερηχογράφημα και χαρτογράφηση των επιχωρίων λεμφαδένων. Ασθενείς με παθολογικούς λεμφαδένες στο υπερηχογράφημα υποβάλλονται σε θεραπευτικό λεμφαδενικό καθαρισμό του σύστοιχου διαμερίσματος ταυτόχρονα με την θυρεοειδεκτομή. Επισημαίνεται ότι οι τυπικά παθολογικοί λεμφαδένες στο υπερηχογράφημα δεν χρήζουν κυτταρολογικής επιβεβαίωσης προκειμένου να αποφασισθεί ο ΠΛΚ. Επίσης, εάν κατά την επέμβαση βρεθούν ανευρεθούν σκληροί, διογκωμένοι ή αποχρωματισμένοι λεμφαδένες πρέπει να γίνει ΠΛΚ χωρίς υποχρεωτικά ταχεία βιοψία.
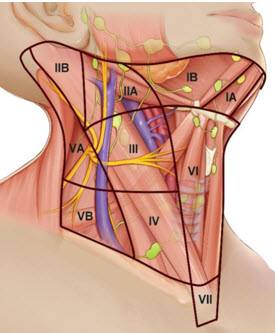
Σε ασθενείς με PTC χωρίς κλινικά ή απεικονιστικά ευρήματα ενδεικτικά για λεμφαδενική διασπορά, μαζί με την θυρεοειδεκτομή προτείνεται να γίνεται ταυτοχρόνως και κεντρικός τραχηλικό προφυλακτικός λεμφαδενικός καθαρισμός (ΠΛΚ). Ως ΠΛΚ ορίζεται ο λεμφαδενικός καθαρισμός που αφορά σε εκτομή του κυτταρολιπώδους ιστού και των λεμφαδένων στο κεντρικό τραχηλικό διαμέρισμα σε ασθενείς με διαγνωσμένο καλά διαφοροποιημένο καρκίνο από FNA, χωρίς να υπάρχει προεγχειρητική (απεικονιστική) η διεγχειρητική (επισκόπηση, ψηλάφηση) υποψία λεμφαδενικών μεταστάσεων. Το κεντρικό τραχηλικό διαμέρισμα (επίπεδο VI) ορίζεται ανατομικά ως ο χώρος με όρια μεταξύ των καρωτίδων στα πλάγια, και μεταξύ υοειδούς οστού και στερνικής εντομής πάνω και κάτω αντίστοιχα. Περιλαμβάνει δηλαδή τους προλαρυγγικούς (δελφικούς), προτραχειακούς και παρατραχειακούς λεμφαδένες. Ο ΠΛΚ διακρίνεται σε ετερόπλευρο και αμφοτερόπλευρο ανάλογα με την έκταση.
Η τυποποιημένη επέμβαση του ΠΛΚ περιλαμβάνει την αφαίρεση όλου του ιστού μεταξύ του άνω ορίου του κρικοειδούς μυός, της ανώνυμης αρτηρίας, της καρωτίδας και την τραχεία. Τυπικά παρασκευάζεται το παλίνδρομο λαρυγγικό σε όλη την πορεία του. Συνήθως είναι αδύνατον να διατηρηθούν οι κάτω παραθυρεοειδείς οι οποίοι και αυτομεταμοσχεύονται.
Επισημαίνεται ότι ο ΠΛΚ αποτελεί ένα από τα πλέον αμφιλεγόμενα θέματα στην χειρουργική του θυρεοειδούς αδένα και απασχολεί την διεθνή βιβλιογραφία εδώ και πολλές δεκαετίες. Το βασικό επιχείρημα όσων υποστηρίζουν τον ΠΛΚ είναι η μείωση των ποσοστών τοπικής υποτροπής και κατά συνέπεια της ανάγκης επανεπεμβάσεων. Από την άλλη, όσοι εναντιώνονται στην σύγχρονη διενέργεια ΠΛΚ αναφέρουν ελάχιστο έως καθόλου ογκολογικό όφελος με αντιθέτως αυξημένα ποσοστά νοσηρότητας και επιπλοκών (υπασβεστιαιμία, κάκωση παλίνδρομου λαρυγγικού νεύρου). Αυτοί πιστεύουν ότι ο ΠΛΚ πρέπει να περιορίζεται μόνο σε ασθενείς με μακροσκοπικές λεμφαδενικές μεταστάσεις.
Ορισμένες μελέτες παρουσιάζουν τον ΠΛΚ του κεντρικού τραχηλικού διαμερίσματος ως καίριο μέσο πρόληψης των μελλοντικών υποτροπών σε όλους τους ασθενείς με διαφοροποιημένο θυρεοειδικό καρκίνο. Υπάρχουν βεβαίως και άλλες μελέτες που δεν επαληθεύουν τη στατιστικώς σημαντική διαφορά στην περιοχική υποτροπή, ενώ αντίθετα αναφέρουν αυξημένα ποσοστά επιπλοκών (π.χ. διπλάσιο κίνδυνο μόνιμου υποπαραθυρεοειδισμού).
Στην κλινική πράξη οι περισσότεροι συγγραφείς προτείνουν, ταυτόχρονα με τη θυρεοειδεκτομή, τον ομόπλευρο με τον καρκίνο ΠΛΚ. Με την στρατηγική αυτή επιτυγχάνονται μειωμένα ποσοστά υποτροπών, αφού αφαιρείται και η μικροσκοπική νόσος, καθώς επίσης και μειωμένα ποσοστά νοσηρότητας, αφού η έκταση του ΠΛΚ περιορίζεται στην μία πλευρά. Περιγράφουν τον ΠΛΚ ως πρώτο βήμα στην πορεία της χειρουργικής επέμβασης, μετά την μερική κινητοποίηση του λοβού και την ταχεία βιοψία των λεμφαδένων με σκοπό την διεγχειρητική σταδιοποίηση της νόσου. Επιπλέον, επί αποδεδειγμένης λεμφαδενικής διασποράς (>5 διηθημένοι λεμφαδένες) διενεργείται αμφοτερόπλευρος ΠΛΚ αφού η μονόπλευρη εντόπιση διηθημένων λεμφαδένων σχετίζεται με αυξημένες πιθανότητες αμφοτερόπλευρης λεμφαδενικής διασποράς. Επιπλέον, ο ΠΛΚ συμβάλλει στην ορθότερη σταδιοποίηση των ασθενών και επηρεάζει την απόφαση για μετεγχειρητική χορήγηση ραδιενεργού ιωδίου- 131.
Στην εποχή της εξατομικευμένης θεραπείας, την τελευταία δεκαπενταετία η γενετική και ο μοριακός έλεγχος έχουν αποκτήσει ξεχωριστή θέση στην διάγνωση και στην θεραπεία του καρκίνου του θυρεοειδούς αδένα. Μεταλλάξεις όπως οι BRAF, RET/PTC και TERT συνδέονται με επιθετικότερες μορφές PTC, ενώ η παρουσία τους αποτελεί ανεξάρτητο, δυσμενή προγνωστικό παράγοντα για την εξέλιξη της νόσου ακόμα και σε χαμηλού κινδύνου για υποτροπή ενδοθυρεοειδικά καρκινώματα. Αρκετοί συγγραφείς υποστηρίζουν ότι η ανάδειξη κάποιων μεταλλάξεων (BRAF, TERT) αποτελεί ισχυρή ένδειξη για πρώιμη λεμφαδενική διασπορά και αυξημένο κίνδυνο υποτροπής σε ασθενείς με κλινικά μη ανιχνεύσιμες μεταστάσεις και προτείνουν την διενέργεια ΠΛΚ σε όλες αυτά τα περιστατικά.
Η τροποποιημένη αμφοτερόπλευρη λεμφαδενεκτομή αποτελεί μεγάλης σπουδαιότητας θεραπευτικό χειρισμό, η οποία επηρεάζει σφόδρα το ογκολογικό αποτέλεσμα καθώς η υποτροπή της νόσου μετά την θυρεοειδεκτομή εμφανίζεται πολύ συχνότερα με την μορφή λεμφαδενικών παρά απομακρυσμένων μεταστάσεων. Οι ειδικοί χειρουργοί προτείνουν την ενσωμάτωση των επιπέδων II-V στον πλάγιο τραχηλικό λεμφαδενικό καθαρισμό, σε ασθενείς με κλινικά εμφανή λεμφαδενική διασπορά της νόσου στο πλάγιο τραχηλικό διαμέρισμα, όπως και στην διενέργεια προφυλακτικού καθαρισμού του κεντρικού διαμερίσματος (VI) όταν διενεργείται πλάγιος λεμφαδενικός καθαρισμός. Ωστόσο είναι άδηλο εάν είναι αναγκαία, από ογκολογικής πλευράς, μια τόσο εκτεταμένη αφαίρεση των λεμφαδένων του πλάγιου τραχηλικού τριγώνου, με δεδομένο ότι η προεγχειρητική απεικόνιση συχνά δεν απεικονίζει νόσο σε όλα τα λεμφαδενικά διαμερίσματα. Λαμβάνοντας αυτό υπόψη, καθώς και το γεγονός ότι ο εκτεταμένος καθαρισμός των πλάγιων τραχηλικών διαμερισμάτων συνδέεται με αυξημένη συχνότητα σοβαρών νευρολογικών τραυματισμών, όπως του παραπληρωματικού νεύρου και κλάδων του αυχενικού ή βραχιονίου πλέγματος, η προοπτική του εκλεκτικού πλάγιου λεμφαδενικού καθαρισμού αποτελεί μία πιο αποδεκτή εναλλακτική χειρουργική στρατηγική. Οι θιασώτες αυτής της χειρουργικής προσέγγισης αναφέρουν ότι στα πλεονεκτήματα της συγκαταλέγεται η μειωμένη επίπτωση της παραισθησίας και της πτώσης του ώμου, οι λιγότερες τεχνικές απαιτήσεις και η πιο εύκολη τυποποίηση της χειρουργικής μεθόδου.
Καταληκτικά, ένα καρκίνωμα με δεδομένη καλοήθη πορεία και άριστα ποσοστά επιβίωσης είναι ίσως το ιδανικότερο πεδίο για εφαρμογή εξατομικευμένης θεραπείας. Τα πρόσφατα βιβλιογραφικά δεδομένα αποκαλύπτουν πως ο δρόμος αυτός είναι ίσως η μόνη ενδεδειγμένη κατευθυντήρια οδηγία με καθολική αποδοχή. Ο μοριακός έλεγχος που οδηγεί στην ανίχνευση των επιθετικών μορφών της νόσου και ο σύστοιχος ΠΛΚ με διενέργεια ταχείας βιοψίας και διεγχειρητική αναδιαμόρφωση της χειρουργικής στρατηγικής ανάλογα με τα αποτελέσματα, πιθανότατα θα αποτελέσουν στο άμεσο μέλλον δύο όπλα που θα επιφέρουν το επιθυμητό αποτέλεσμα, βέλτιστη ογκολογική θεραπεία και ελάχιστη νοσηρότητα.
Αποτελέσματα
Σε ασθενείς με PTC χαμηλού κινδύνου η χειρουργική εκτομή εξασφαλίζει την επιμήκυνση του προσδόκιμου επιβίωσης στο 95% των ασθενών από 5 έως 10 έτη. Για μεγαλύτερες βλάβες, η επιβίωση είναι μειωμένη, ειδικότερα σε ηλικιωμένους ασθενείς. Η υποτροπή σε τοπικούς ή περιοχικούς λεμφαδένες μετά την αρχική χειρουργική αντιμετώπιση μπορεί να αντιμετωπιστεί με συμπληρωματική εκτομή, εφόσον έχει παραμείνει υπολειμματικός θυρεοειδικός ιστός σε συνδυασμό με περιοχικό λεμφαδενικό καθαρισμό.
Μετά την εγχείρηση, εφόσον το καρκίνωμα είναι αμιγώς θηλώδες δεν χορηγείται ραδιενεργό ιώδιο. Αν όμως περιέχει και θυλακιώδη στοιχεία τότε μπορεί να χορηγηθεί θεραπευτικά ραδιενεργό ιώδιο-131. Η ένδειξη φυσικά για χορήγηση ραδιενεργού ιωδίου είναι απόλυτη ως συμπληρωματική θεραπεία σε προχωρημένο καρκίνωμα και σε μεταστατική νόσο, με την προϋπόθεση ότι τα καρκινικά κύτταρα προσλαμβάνουν ιώδιο. Οι απομακρυσμένες μεταστάσεις είναι σπάνιες και χαρακτηρίζονται από δυσμενή πρόγνωση.
Η υποτροπή του PTC μπορεί να συμβεί σε οποιαδήποτε φάση της ζωής του ασθενούς και για το λόγο αυτό απαιτείται δια βίου επαγρύπνηση. Σε ασθενείς που έχουν υποβληθεί σε ολική θυρεοειδεκτομή, η παρακολούθηση των επιπέδων θυρεοσφαιρίνης είναι σημαντική για την πρώιμη διάγνωση ενδεχόμενης υποτροπής. Δυστυχώς, το 1/3 των ασθενών με υποτροπή PTC, θα καταλήξουν από την νόσο.
Η ορμονοθεραπεία με θυροξίνη είναι απαραίτητη γιατί τα θηλώδη καρκινώματα είναι ορμονοευαίσθητα. Χορηγείται τόση θυροξίνη (200-300μg/ημερησίως) ώστε να ανασταλεί πλήρως η έκκριση της TSH από την υπόφυση.
Θηλώδες μικροκαρκίνωμα
 O κίνδυνος υποτροπής ενός μονοεστιακού θηλώδους μικροκαρκινώματος του θυρεοειδούς (PTMC) υπολογίζεται σε ποσοστό μόνο 1-2%. Πολλοί συγγραφείς πιστεύουν ότι στους ασθενείς χαμηλού κινδύνου για υποτροπή της νόσου η κλασική ολική θυρεοειδεκτομή δεν είναι η βέλτιστη θεραπευτική προσέγγιση. Στις περιπτώσεις αυτές προτείνονται αρκετές εξ ίσου αποτελεσματικές θεραπευτικές επιλογές, όπως η ενεργητική παρακολούθηση, η κατάλυση (ablation) του όζου με laser, ραδιοσυχνότητες ή μικροκύματα, καθώς και η ελάχιστα επεμβατική θυρεοειδεκτομή.
O κίνδυνος υποτροπής ενός μονοεστιακού θηλώδους μικροκαρκινώματος του θυρεοειδούς (PTMC) υπολογίζεται σε ποσοστό μόνο 1-2%. Πολλοί συγγραφείς πιστεύουν ότι στους ασθενείς χαμηλού κινδύνου για υποτροπή της νόσου η κλασική ολική θυρεοειδεκτομή δεν είναι η βέλτιστη θεραπευτική προσέγγιση. Στις περιπτώσεις αυτές προτείνονται αρκετές εξ ίσου αποτελεσματικές θεραπευτικές επιλογές, όπως η ενεργητική παρακολούθηση, η κατάλυση (ablation) του όζου με laser, ραδιοσυχνότητες ή μικροκύματα, καθώς και η ελάχιστα επεμβατική θυρεοειδεκτομή.
Η χειρουργική προσέγγιση περιλαμβάνει την λοβεκτομή, η οποία αποτελεί εξαιρετική επιλογή σε μονοεστιακούς, ενδοθυρεοειδικούς όγκους, με μέγεθος <1 cm, χωρίς ύποπτους λεμφαδένες και χωρίς ενδείξεις μεταστάσεων. Στις επικαιροποιημένες ογκολογικές κατευθυντήριες οδηγίες, οι ασθενείς χωρίς ιστορικό έκθεσης σε ακτινοβολία, οικογενειακό ιστορικό καρκίνου θυρεοειδούς, οπίσθια επέκταση του όγκου προς την τραχεία, επιθετικά χαρακτηριστικά στις κυτταρολογικές εξετάσεις ή εξωθυρεοειδική επέκταση, θεωρούνται κατάλληλοι υποψήφιοι είτε για λοβεκτομή είτε για ενεργητική παρακολούθηση. Η λοβεκτομή, χωρίς θεραπεία με ραδιενεργό ιώδιο θεωρείται ιδανική για ασθενείς με καρκίνο θυρεοειδούς που ταξινομείται ως cT1aN0M0.
Οι ασθενείς που υποβάλλονται σε λοβεκτομή θα πρέπει να παρακολουθούνται τακτικά μετά την επέμβαση, καθώς εξακολουθούν να έχουν μικρό, αλλά υπολογίσιμο κίνδυνο υποτροπής. Συστήνεται υπερηχογράφημα τραχήλου υψηλής ποιότητας κάθε έξι μήνες και προαιρετικά μπορούν να ακολουθήσουν θεραπεία με λεβοθυροξίνη, ώστε τα επίπεδα της TSH ορού να κυμαίνονται σε τιμές των 0,5 -2μIU/mL. Επί καλής ανταπόκρισης, στην συνέχεια η παρακολούθηση γίνεται σε ετήσια βάση με υπερηχογράφημα και μέτρηση των επιπέδων θυρεοσφαιρίνης και αντιθυρεοειδικής σφαιρίνης.
Έως και το 43% των ασθενών που υποβάλλονται σε λοβεκτομή, ενδέχεται να χρειαστεί να υποβληθούν σε ολική θυρεοειδεκτομή μεταγενέστερα λόγω ανίχνευσης παραγόντων υψηλού κινδύνου μετεγχειρητικά. Είναι επομένως ορθό να ενημερώνεται προεγχειρητικά ο ασθενής πως η αρχική λοβεκτομή δεν θα είναι με βεβαιότητα η οριστική αντιμετώπιση στο 1/3 τουλάχιστον των ασθενών. Πρόσφατα προτάθηκε η χρήση προγνωστικών μοριακών δεικτών για την διαστρωμάτωση του κινδύνου και την διαχείριση του καρκίνου του θυρεοειδούς. Οι ασθενείς χωρίς μεταλλάξεις ή με μεταλλάξεις μη επιθετικού τύπου είναι κατάλληλοι υποψήφιοι για ενεργητική παρακολούθηση. Οι ασθενείς με μεμονωμένες μεταλλάξεις, όπως στο γονίδιο BRAF ή στο RAS θα πρέπει να υποβάλλονται σε λοβεκτομή, ενώ εκείνοι με γονότυπους υψηλού κινδύνου για υποτροπή είναι υποψήφιοι για ολική θυρεοειδεκτομή.
Η ιδέα για ενεργητική παρακολούθηση του θηλώδους μικροκαρκίνωμα προτάθηκε το 1993 από τον Miyauchi στην Ιαπωνία και επικράτησε παγκοσμίως μετά την δημοσίευση των αμερικάνικων κατευθυντήριων οδηγιών το 2015. Σύμφωνα με αυτές, η ενεργητική παρακολούθηση θα πρέπει να είναι η πρώτη επιλογή σε ασθενείς με PTMC, λόγω του χαμηλού ποσοστού υποτροπών. Τα πρώτα δυο έτη οι ασθενείς θα πρέπει να παρακολουθούνται με υπερηχογράφημα τραχήλου κάθε έξι μήνες και ακολούθως, επί μη εξέλιξης της νόσου, ετησίως.
Κατάλληλοι υποψήφιοι για ενεργητική παρακολούθηση είναι οι ασθενείς ηλικίας >60 ετών με ενδοθυρεοειδικό όγκο, καθώς και ασθενείς ηλικίας 18 – 59 ετών, που συναινούν στην επιλογή της ενεργητικής παρακολούθησης και σε μελλοντική χειρουργική επέμβαση σε περίπτωση εξέλιξης της νόσου. Η εξωθυρεοειδική επέκταση δεν αποτελεί ισχυρή αντένδειξη, όμως, σε περιπτώσεις διήθησης του παλίνδρομου λαρυγγικού νεύρου ή διήθησης της τραχείας δεν συστήνεται η ενεργητική παρακολούθηση. Φαίνεται, πάντως, πως η ενεργητική παρακολούθηση είναι μια αποδεκτή εναλλακτική αντί της χειρουργικής επέμβασης, σε ασθενείς χωρίς αυξημένο κίνδυνο υποτροπή με κύριο πλεονέκτημα την αποφυγή των διεγχειρητικών επιπλοκών.
Η ενεργητική παρακολούθηση θεωρείται ως μία ασφαλής στρατηγική με θετικά αποτελέσματα ως προς την ποιότητα ζωής και με χαμηλό κόστος, αν και οι κατευθυντήριες οδηγίες ποικίλουν ευρέως από χώρα σε χώρα. Στην Ευρώπη χρησιμοποιείται συχνότερα η λοβεκτομή, επειδή τα μέχρι στιγμής αποδεικτικά στοιχεία για την ασφάλεια της ενεργητικής παρακολούθησης είναι περιορισμένα. Αυτό οφείλεται στο γεγονός ότι η εφαρμογή της ενεργητικής παρακολούθησης είναι δυσχερής, καθώς η πολυοζώδης βρογχοκήλη είναι πιο διαδεδομένη σε σχέση με τις μονήρεις βλάβες, ενώ υπάρχουν εμφανίζονται πολλές περιπτώσεις αυτοάνοσης θυρεοειδίτιδας. Επιπρόσθετα, η ανίχνευση μοριακών δεικτών βρίσκεται ακόμα σε πρώιμο κλινικό στάδιο, ενώ σημαντικές είναι οι διαφορές στην οργάνωση και την χρηματοδότηση των συστημάτων υγείας κάθε χώρας. Αν και ακόμα ακολουθείται μια πιο συντηρητική προσέγγιση στην θεραπεία του καρκίνου, η ενεργητική παρακολούθηση θα πρέπει να εφαρμόζεται σε μεγάλα ιατρικά κέντρα, στο πλαίσιο κλινικών ερευνητικών προγραμμάτων.
Σύμφωνα με τις κατευθυντήριες οδηγίες της Ιαπωνικής Εταιρίας Χειρουργικής Ενδοκρινών Αδένων, οι ενδείξεις για άμεση χειρουργική αντιμετώπιση του θηλώδους μικροκαρκινώματος είναι οι ακόλουθες:
- Μετάσταση σε λεμφαδένες ή απομακρυσμένες μεταστάσεις
- Κλινικά εικόνα διήθησης του παλίνδρομου λαρυγγικού νεύρου ή της τραχείας
- Διάγνωση επιθετικού υπότυπου στην κυτταρολογική εξέταση
- Προσκόλληση του όγκου στην τραχεία
- Εντόπιση κατά μήκος της πορείας του παλίνδρομου λαρυγγικού νεύρου
- Όγκοι που σχετίζονται με άλλη νόσο του θυρεοειδούς ή του παραθυρεοειδούς που απαιτεί χειρουργική επέμβαση
- Ηλικία <20 ετών
Οι ενδείξεις για χειρουργική επέμβαση μετά από ενεργητική παρακολούθηση είναι οι κάτωθι:
- Η διάμετρος του όγκου είναι >13 mm
- Η ανάδειξη μεταστάσεων στους λεμφαδένες
- Η επιθυμία του ασθενούς
- Η εμφάνιση άλλης νόσου του θυρεοειδούς ή των παραθυρεοειδών που απαιτεί χειρουργική επέμβαση
Η κατάλυση του θηλώδους μικροκαρκινώματος μπορεί να γίνει υπό υπερηχογραφική καθοδήγηση, είτε με laser είτε με ραδιοσυχνότητες ή μικροκύματα. Αυτή η μορφή θεραπείας μπορεί να πραγματοποιηθεί σε επίπεδο εξωτερικού ιατρείου, διαρκεί λίγο, απαιτεί τοπική αναισθησία και ο ασθενής εξέρχεται άμεσα.
Οι ευρωπαϊκές κατευθυντήριες οδηγίες σχετικά με την κατάλυση του θηλώδους μικροκαρκινώματος στις ενδείξεις περιλαμβάνουν τα εξής: την μεγάλη ηλικία, τις συννοσηρότητες, την απουσία οικογενειακού ιστορικού επιθετικών μορφών, την ετερόπλευρη παράλυση των φωνητικών χορδών και την άρνηση του ασθενούς για χειρουργική αντιμετώπιση. Επιπλέον, ο όγκος πρέπει να είναι μονήρης, με κεντρική εντόπιση, σαφή όρια, χωρίς επαφή με την θυρεοειδική κάψα και χωρίς εξωθυρεοειδική επέκταση. Θεωρείται, επομένως, αναγκαίο για τον κλινικό ιατρό να εξειδικεύεται στις τεχνικές κατάλυσης υπό υπερηχογραφική καθοδήγηση.
Πρόσφατες μελέτες σε ασθενείς με θηλώδες μικροκαρκίνωμα που υποβλήθηκαν σε κατάλυση έχουν δείξει χαμηλά ποσοστά μετεπεμβατικών επιπλοκών, υποτροπής ή τοπικής μετάστασης και απουσία απομακρυσμένων μεταστάσεων δύο έτη μετά την επέμβαση. Η κατάλυση με ραδιοσυχνότητες έχει τα καλύτερα αποτελέσματα σε σύγκριση με την κατάλυση με μικροκύματα και laser, αν και η κατάλυση με laser παρουσιάζει μεγαλύτερη ασφάλεια και μικρότερο ποσοστό επιπλοκών.
Επιθετικά θηλώδη καρκινώματα
Αιτιοπαθογενετικά το θηλώδες καρκίνωμα οφείλεται σε γονιδιακές μεταλλάξεις ή μετατοπίσεις. Οι μεταλλάξεις των γονιδίων BRAF RET/PTC και TERT συσχετίζονται με επιθετικότερες μορφές θηλώδους καρκινώματος. Ποσοστό 45% των θηλωδών καρκινωμάτων προκαλούνται από αυξημένη έκφραση του ογκογονιδίου λόγω της μετατόπισης και ενσωμάτωσης συγκεκριμένων προωθητών σε αυτό, με αποτέλεσμα την δημιουργία retPTC-1, retPTC-2 και retPTC-3. Υποστηρίζεται επίσης ότι η παρουσία κάποιων μεταλλάξεων (BRAF, TERT) συσχετίζεται με αυξημένη συχνότητα λεμφαδενικών μεταστάσεων και αυξημένο κίνδυνο υποτροπής. Αξίζει να σημειωθεί, επίσης, ότι η απώλεια του ογκοκατασταλτικού γονιδίου μπορεί να προκαλέσει την μετάπτωση του θηλώδους σε αναπλαστικό καρκίνωμα.
Σύμφωνα με την ταξινόμηση του WHO ως επιθετικοί υπότυποι με βάση την μορφολογία αναγνωρίζονται εκείνα με υψηλά κύτταρα (tall cell), τα hobnail και τα κυλινδρικά διαφοροποιημένα καρκινώματα του θυρεοειδούς. Με βάση δε την αρχιτεκτονική, ως επιθετικοί όγκοι ορίζονται εκείνοι που εμφανίζουν συμπαγές, νησιδώδες ή δοκιδώδες πρότυπο και έχουν αυξημένες μιτώσεις, Ki67 πάνω από 10% ή υπάρχει διήθηση αγγείων. Οι επιθετικοί τύποι του θηλώδους καρκινώματος επεκτείνονται πρώιμα στους πέριξ ιστούς με μικρο- ή μακροδιήθηση σε ποσοστό 10%, εμφανίζουν φτωχή ανταπόκριση στην θεραπεία, υψηλά ποσοστά υποτροπών και μεταστάσεων, μεγάλη νοσηρότητα και αποτελούν αιτία θανάτου στο ένα τρίτο των ασθενών.
Οι ιστολογικοί υπότυποι του θηλώδους καρκινώματος με επιθετική βιολογική συμπεριφορά είναι οι εξής:
- Τύπος από υψηλά κύτταρα – Tall cell variant (TCV). Ο υπότυπος αυτός έχει χαρακτηριστικά κύτταρα θηλώδους ανάπτυξης, το ύψος των οποίων στο 30% είναι 3 φορές μεγαλύτερο από το πλάτος τους και αντιστοιχεί στο 8% όλων των παραλλαγών του θηλώδους καρκινώματος. Οι όγκοι TCV διακατέχονται από επιθετικά χαρακτηριστικά, όπως εξωθυρεοειδική επέκταση, πολυεστιακότητα, λεμφαδενικές μεταστάσεις, διήθηση αγγείων, μεγάλη συχνότητα υποτροπών και απομακρυσμένων μεταστάσεων. Αυτοί οι παράγοντες είναι υπεύθυνοι για υψηλότερα ποσοστά υποτροπών και χειρότερη πρόγνωση του TCV, συγκριτικά με το κλασικό PTC. Θεωρείται ανεξάρτητος δυσμενής παράγοντας και οι ασθενείς αυτοί εμφανίζουν υψηλότερη συνολική θνητότητα στα 10 χρόνια (έως και 22% για ασθενείς με TCV, σε σύγκριση με 8,6% για PTC). Η χειρότερη πρόγνωση αφορά ακόμη και στους ενδοθυρεοειδικούς όγκους ανεξάρτητα από την ηλικία, το μέγεθος και το στάδιο. Στο 80% των ασθενών αναγνωρίζεται μετάλλαξη του BRAF γονιδίου. Για τους προαναφερόμενους λόγους υιοθετείται επιθετική χειρουργική θεραπεία ειδικά στα πρώιμα στάδια της νόσου, η οποία εκτός από την θυρεοειδεκτομή περιλαμβάνει και τον κεντρικό λεμφαδενικό καθαρισμό, συμπληρωματική θεραπεία με ραδιενεργό ιώδιο και στενή παρακολούθηση. Ωστόσο, ο θηλώδης καρκίνος από υψηλά κύτταρα αποτελεί την κύρια μορφή με αντοχή στο ραδιενεργό ιώδιο. Επομένως, η επικουρική θεραπεία με ραδιενεργό ιώδιο μπορεί να μην είναι αρκετή για να περιορίσει τις λεμφαδενικές τραχηλικές μεταστάσεις. Επίσης, η θεραπεία με ραδιενεργό ιώδιο δεν είναι ικανή να υποκαταστήσει την χειρουργική διαχείριση του κεντρικού τραχηλικού διαμερίσματος.
- Τύπος από κυλινδρικά κύτταρα Columnar cell CCV (0.2 – 1,5%). Ο τύπος του θηλώδους καρκινώματος από κυλινδρικά κύτταρα (CCV) είναι ο σπανιότερος των θηλωδών καρκινωμάτων και εμφανίζεται σε άνδρες ηλικίας γύρω στα 55 έτη. Ο υπότυπος αυτός χαρακτηρίζεται από ταχεία ανάπτυξη, τοπική εξωθυρεοειδική επέκταση σε γειτονικές δομές σε ποσοστό 85%, αυξημένα ποσοστά λεμφαδενικών μεταστάσεων και υποτροπών. Στο υπερηχογράφημα απεικονίζονται ως συμπαγείς υποηχογενείς όζοι με αποτιτανώσεις. Η αντιμετώπιση των ασθενών με CCV-PTC είναι εξατομικευμένη και βασίζεται στο κλινικό στάδιο της νόσου παρά στην ιστομορφολογική του εμφάνιση.
- Τύπος «Hobnail» – Hobnail HVPTC (0,3% – 2,7%). Ο τύπος του θηλώδους καρκινώματος από κύτταρα τύπου «Hobnail» (HVPTC) είναι μια ιστολογική παραλλαγή των θηλωδών καρκινωμάτων (PTC). Χαρακτηρίζεται από συχνές μεταλλάξεις του BRAF και του TΡ53. Ποσοστό >30% των καρκινικών κυττάρων εμφανίζουν κυτταρομορφολογικά χαρακτηριστικά χοάνης. Αυτός ο όγκος χαρακτηρίζεται από επιθετική συμπεριφορά, διήθηση αγγείων, εξωθυρεοειδική επέκταση, συχνές μεταστάσεις στους πνεύμονες, αντοχή στην θεραπεία, αυξημένα ποσοστά υποτροπών και 10ετή επιβίωση 64%.
- Συμπαγής τύπος – Solid/Trabecular (SVPTC). Ο συμπαγής τύπος του θηλώδους καρκινώματος (SVPTC) είναι μια ιστολογική παραλλαγή του PTC, η οποία αναφέρεται σε ένα θηλώδες καρκίνωμα με σταθερό πρότυπο ανάπτυξης που υπάρχει σε ολόκληρο τον όγκο. Το SVPTC είναι σπάνιο, αντιπροσωπεύοντας το 2-3% των παραλλαγών PTC και έχει τεκμηριωθεί σε μεγάλο βαθμό σε παιδιά. Υπάρχει ένας αυξημένος επιπολασμός (30%) αυτής της παραλλαγής σε επιζώντες του ατυχήματος του Τσερνομπίλ. Ωστόσο, ο SVPTC μπορεί να παρατηρηθεί σε παιδιά χωρίς έκθεση σε ακτινοβολία. Το SVPTC σχετίζεται με υψηλότερη συχνότητα απομακρυσμένων μεταστάσεων κυρίως στους πνεύμονες και έχει δυσμενέστερη πρόγνωση σε σύγκριση με το κλασικό PTC. Θα πρέπει να γίνεται διαφορική διάγνωση από το θυλακιώδες και το φτωχά διαφοροποιημένο θυρεοειδικό καρκίνο.
- Διάχυτα σκληρυντικός τύπος – Diffuse sclerosing (DSV). Η ποικιλία αυτή αντιστοιχεί στο 6% των θηλωδών καρκινωμάτων (DSV) και χαρακτηρίζεται από την ύπαρξη ψαμμωδών σωματίων, από πλακώδη μεταπλασία και λεμφοκυτταρικές διηθήσεις. Εμφανίζεται συχνότερα σε παιδιά και νεαρές γυναίκες και είναι ευαίσθητο στην θεραπεία με ραδιενεργό ιώδιο. Χαρακτηριστικές είναι οι «δίκην χιονοθύελας» (snow storm) επασβεστώσεις στο υπερηχογράφημα, συνδυάζεται με την νόσο Hashimoto, εμφανίζει αυξημένα ποσοστά διήθησης των λεμφαδένων και μεθίσταται στους πνεύμονες σε ποσοστό 13%. Η κυτταρολογική διαφορική διάγνωση του DSV περιλαμβάνει την χρόνια λεμφοκυτταρική θυρεοειδίτιδα και το λέμφωμα. Η παρουσία αναδιάταξης RET/PTC παρατηρείται συχνότερα σε όγκους που παρατηρούνται σε παιδιά και νεαρούς ενήλικες, ειδικά σε αυτούς που σχετίζονται με έκθεση σε ακτινοβολία. Η ανίχνευσή της μπορεί επίσης να εξηγήσει την ευαισθησία του DSV στην θεραπεία με ραδιενεργό ιώδιο. Το DSV είναι πράγματι μια επιθετική παραλλαγή του PTC, με μεταστάσεις στους λεμφαδένες σε ποσοστό σχεδόν 100% των ασθενών, καθώς και συχνές απομακρυσμένες μεταστάσεις. Ωστόσο, παρά την επιθετική συμπεριφορά του, η πρόγνωση του DSV είναι συχνά συγκρίσιμη με εκείνη του κλασικού PTC, πιθανά λόγω του νεαρού της ηλικίας των ασθενών.
- Ογκοκυτταρικός τύπος – Oncocytic not specified. Ο σπάνιος αυτός υπότυπος θηλώδους καρκινώματος (1,1%) είναι σχετικά επιθετικός, έχει υψηλότερο ποσοστό υποτροπής και θνητότητας σε σχέση με το κλασσικό θηλώδες PTC. Τα κύτταρα σε αυτόν τον τύπο εμφανίζουν παρόμοια πυρηνικά χαρακτηριστικά με τα κλασσικά θηλώδηκαρκινώματα.
Χειρουργική στρατηγική στα επιθετικά PTC
 Η πρόγνωση του θηλώδους καρκινώματος είναι καλή με την προϋπόθεση ότι αντιμετωπίζεται εξ αρχής σωστά. Η 10ετής επιβίωση ανέρχεται στο 95%. Ένα μεγάλο μειονέκτημα των συστημάτων ταξινόμησης που χρησιμοποιούνται σήμερα είναι ότι κατηγοριοποιούν τους ασθενείς με βάση την ηλικία, το μέγεθος του όγκου, την επέκταση, την αγγειακή διήθηση, τις λεμφαδενικές και απομακρυσμένες μεταστάσεις, αλλά όχι τον ιστολογικό υπότυπο και το εύρος της χειρουργικής θεραπείας που έχει εφαρμοστεί. Θα πρέπει επομένως να γίνει μια καλή προεγχειρητική σταδιοποίηση, που θα αξιολογεί την επιθετικότητα της νόσου, ώστε να σχεδιαστεί η κατάλληλη χειρουργική θεραπεία για να αντιμετωπιστεί ο όγκος του θυρεοειδούς, η εξωθυρεοειδική επέκταση στους γύρω ιστούς, οι επιχώριες και απομακρυσμένες λεμφαδενικές μεταστάσεις. Τέτοιες ενδείξεις μπορούν να αποκτηθούν από τον απεικονιστικό έλεγχο με βάση το μέγεθος και την θέση του όγκου, την διήθηση της κάψας και των γειτονικών δομών και τα ευρήματα από την χαρτογράφηση του τραχήλου.
Η πρόγνωση του θηλώδους καρκινώματος είναι καλή με την προϋπόθεση ότι αντιμετωπίζεται εξ αρχής σωστά. Η 10ετής επιβίωση ανέρχεται στο 95%. Ένα μεγάλο μειονέκτημα των συστημάτων ταξινόμησης που χρησιμοποιούνται σήμερα είναι ότι κατηγοριοποιούν τους ασθενείς με βάση την ηλικία, το μέγεθος του όγκου, την επέκταση, την αγγειακή διήθηση, τις λεμφαδενικές και απομακρυσμένες μεταστάσεις, αλλά όχι τον ιστολογικό υπότυπο και το εύρος της χειρουργικής θεραπείας που έχει εφαρμοστεί. Θα πρέπει επομένως να γίνει μια καλή προεγχειρητική σταδιοποίηση, που θα αξιολογεί την επιθετικότητα της νόσου, ώστε να σχεδιαστεί η κατάλληλη χειρουργική θεραπεία για να αντιμετωπιστεί ο όγκος του θυρεοειδούς, η εξωθυρεοειδική επέκταση στους γύρω ιστούς, οι επιχώριες και απομακρυσμένες λεμφαδενικές μεταστάσεις. Τέτοιες ενδείξεις μπορούν να αποκτηθούν από τον απεικονιστικό έλεγχο με βάση το μέγεθος και την θέση του όγκου, την διήθηση της κάψας και των γειτονικών δομών και τα ευρήματα από την χαρτογράφηση του τραχήλου.
Σύμφωνα με τις επικαιροποιημένες κατευθυντήριες οδηγίες οι επιθετικοί ιστολογικοί υπότυποι του θηλώδους καρκινώματος χαρακτηρίζονται ως ενδιάμεσου κινδύνου με πιθανότητα υποτροπής 15%. Οι ασθενείς με ιστολογική ένδειξη από την βιοψία ενός επιθετικού υπότυπου, θα πρέπει να αντιμετωπίζονται επιθετικά χειρουργικά λόγω της δυσμενούς βιολογικής συμπεριφοράς των όγκων αυτών. Είναι σημαντικό λοιπόν να γνωρίζουμε από πριν τον επιθετικό τύπο θηλώδους καρκινώματος γιατί οι υπότυποι αυτοί επιδεικνύουν επιθετική βιολογική συμπεριφορά ανεξάρτητα από το μέγεθος, το φύλο και την ηλικία. Ακόμη και όταν είναι αυστηρά ενδοθυρεοειδικοί οι όγκοι αυτοί, εμφανίζουν συχνότερα λεμφαδενικές μεταστάσεις. Είναι συχνά ανθεκτικοί στο ιώδιο και εμφανίζουν υψηλότερο κίνδυνο αποδιαφοροποίησης.
Η κατάσταση των λεμφαδένων του κεντρικού διαμερίσματος έχει προγνωστική αξία, ειδικά στην ολική επιβίωση, ανεξάρτητα από το στάδιο ή την χορήγηση ραδιενεργού ιωδίου. Οι μικρομεταστάσεις που ανευρίσκονται στο κεντρικό τραχηλικό διαμέρισμα συσχετίζονται με μειωμένη επιβίωση. Αξίζει να σημειωθεί ότι το 1/3 των ασθενών με διαφοροποιημένο καρκίνο θυρεοειδούς (DTC) εμφανίζει λεμφαδενικές μεταστάσεις κατά την διάγνωση (cN1), μολονότι η κλινική σημασία των μικρομεταστάσεων αυτών είναι αμφιλεγόμενη. (Οι pN1 ασθενείς με μικρομεταστάσεις έχουν ίδιο ποσοστό υποτροπής με τους cN0 σε αντίθεση με τους cN1 (3% έναντι 22%). Οι λεμφαδενικές αυτές μεταστάσεις του τραχήλου σχετίζονται με αυξημένο κίνδυνο υποτροπής της νόσου, ενώ οι διηθημένοι λεμφαδένες θεωρούνται ανεξάρτητος παράγοντας κινδύνου υποτροπής.
Οι επιθετικοί υπότυποι του καλά διαφοροποιημένου καρκίνου του θυρεοειδούς, απαιτούν επιθετικότερη χειρουργική θεραπεία σε συνδυασμό με ραδιενεργό ιώδιο και στενότερη παρακολούθηση. Θα πρέπει να αξιοποιούνται στο έπακρο τα δεδομένα της προεγχειρητικής αξιολόγησης και να γίνεται εξατομίκευση στην διάγνωση και θεραπεία, μελλοντικά ίσως με προεγχειρητικό γονιδιακό έλεγχο, ώστε ούτε να υποθεραπεύουμε ούτε να υπερθεραπεύουμε ασθενείς με θυρεοειδικό καρκίνο.
Στους επιθετικούς υπότυπους η θυρεοειδεκτομή θα πρέπει να συμπληρώνεται από προληπτικό ή θεραπευτικό κεντρικό λεμφαδενικό καθαρισμό. Όπως προαναφέρθηκε, ως προφυλακτικός ορίζεται ο λεμφαδενικός καθαρισμός ο οποίος εκτελείται χωρίς την προεγχειρητική ή διεγχειρητική διάγνωση λεμφαδενικών μεταστάσεων στο κεντρικό λεμφαδενικό διαμέρισμα του τραχήλου σε ασθενείς με καλά διαφοροποιημένο καρκίνο από FNA. Συνιστάται να γίνεται σε Τ3/T4 όγκους ενώ να αποφεύγεται σε Τ1/ T2 όγκους. Προφυλακτικός πλάγιος λεμφαδενικός καθαρισμός δεν προτείνεται, αλλά όταν αποδεδειγμένα υπάρχει μεταστατική νόσος, οπωσδήποτε θα πρέπει να περιλαμβάνονται και τα επίπεδα II και IV στο πλάνο της χειρουργικής θεραπείας.
Τεχνική του κεντρικού λεμφαδενικού καθαρισμού στα επιθετικά PTC
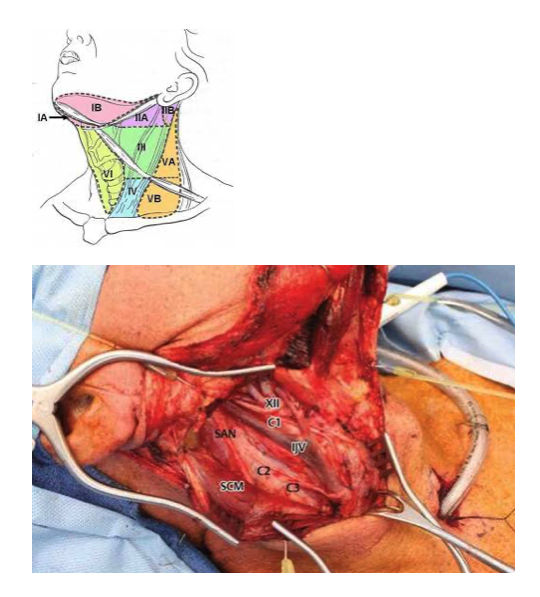 Τα ανατομικά όρια του κεντρικού λεμφαδενικού καθαρισμού (pCCND) είναι τα εξής. Άνω: υοειδές οστούν. Κάτω: βραχιοκεφαλική/ανώνυμη φλέβα. Έσω: τραχεία. Έξω: κοινή καρωτίδα αρτηρία. Πρόσθιο: το επιπολής πέταλο της εν τω βάθει τραχηλικής περιτονίας. Οπίσθιο: το εν τω βάθει πέταλο της εν τω βάθει τραχηλικής περιτονίας.
Τα ανατομικά όρια του κεντρικού λεμφαδενικού καθαρισμού (pCCND) είναι τα εξής. Άνω: υοειδές οστούν. Κάτω: βραχιοκεφαλική/ανώνυμη φλέβα. Έσω: τραχεία. Έξω: κοινή καρωτίδα αρτηρία. Πρόσθιο: το επιπολής πέταλο της εν τω βάθει τραχηλικής περιτονίας. Οπίσθιο: το εν τω βάθει πέταλο της εν τω βάθει τραχηλικής περιτονίας.
Ο καθαρισμός ξεκινάει από το σημείο που φαίνεται το κάτω λαρυγγικό νεύρο και για ασφάλεια γίνεται με χρήση νευροδιεγέρτη. Αποκαλύπτεται το νεύρο και ακολουθείται σε όλη την πορεία. Δεξιά υπάρχουν λεμφαδένες και όπισθεν του νεύρου οι οποίοι πρέπει να αφαιρούνται κυρίως στο θεραπευτικό κεντρικό λεμφαδενικό καθαρισμό. Επί τα εκτός τερματίζεται στο σημείο που περνάει το νεύρο κάτω από την υποκλείδιο και παλινδρομεί. Η τεχνική απαιτεί ευρεία γνώση της ανατομίας της περιοχής και των πιθανών παραλλαγών, που είναι αρκετές. Χρήσιμη είναι η τοποθέτηση Levin, για την διεγχειρητική αναγνώριση και παρακολούθηση του οισοφάγου. Επισημαίνεται ότι το δεξιό παλίνδρομο λαρυγγικό νεύρο διατρέχει επί τα έξω ενώ το αριστερό βρίσκεται πλησίον της τραχείας και πάνω από τον οισοφάγο.
Ποσοστό 25% των ασθενών με καρκίνο θυρεοειδούς εμφανίζουν υποτροπή της νόσου λόγω των υποκλινικών λεμφαδενικών μεταστάσεων. Αποδεδειγμένα οι λεμφαδενικές μεταστάσεις αποτελούν ανεξάρτητο παράγοντα κινδύνου για μειωμένη επιβίωση. Η εφαρμογή του pCCND σχετίζεται με χαμηλότερα ποσοστά τοπικής υποτροπής, σε σύγκριση με την ολική θυρεοειδεκτομή μόνο. Ο pCCND επιμηκύνει το ελεύθερο νόσου διάστημα των ασθενών με θυρεοειδικό καρκίνο.
Η λεμφαδενική διασπορά στα πλάγια τραχηλικά διαμερίσματα είναι συχνότερη στα θηλώδη και ειδικά στους επιθετικούς υπότυπους. Στις κατευθυντήριες οδηγίες συστήνεται η ενσωμάτωση των επιπέδων II-V στον πλάγιο τραχηλικό λεμφαδενικό καθαρισμό, σε ασθενείς με κλινικά εμφανή λεμφαδενική διασπορά στο πλάγιο τραχηλικό διαμέρισμα. Στον πλάγιο λεμφαδενικό καθαρισμό πρέπει να προσεχθούν τα αγγειακά στελέχη (κοινή καρωτίδα και ο διχασμός της και η έσω σφαγίτιδα), τα λεμφαγγειακά στελέχη (μείζων θωρακικός πόρος αριστερά και ελάσσων δεξιά) και τα νεύρα (πνευμονογαστρικό, φρενικό, βραχιόνιο πλέγμα, παραπληρωματικό νεύρο, υπογλώσσιο και οι αισθητικοί κλάδοι του αυχενικού πλέγματος).
Η προοπτική του εκλεκτικού πλάγιου λεμφαδενικού καθαρισμού θα πρέπει μάλλον να αποκλεισθεί σαν εναλλακτική χειρουργική στρατηγική, δεδομένης της αδυναμίας προεγχειρητικού αλλά και διεγχειρητικού αποκλεισμού της λανθάνουσας λεμφαδενικής διασποράς. Η ανάδειξη του ιστολογικού τύπου δυστυχώς γίνεται μετεγχειρητικά και ο γονιδιακός έλεγχος δεν επιβεβαιώνει τον τύπο παρά μόνο την πιθανότητα μεταστάσεων και τον κίνδυνο υποτροπής. Επομένως, προεγχειρητικά δεν μπορεί ποτέ ο χειρουργός να γνωρίζει απόλυτα ποιόν υπότυπο θηλώδους αντιμετωπίζει. Εφόσον λοιπόν υπάρχει δυνατότητα ανίχνευσης των μεταλλάξεων τότε θα μπορούσε να αιτιολογηθεί ένα πιο εκτεταμένο χειρουργείο, αναφορικά με την αφαίρεση των λεμφαδένων του κεντρικού διαμερίσματος.
Καταληκτικά, στην εποχή της εξατομικευμένης θεραπείας, στον επιθετικό θηλώδες καρκίνωμα οφείλουμε να χειρουργούμε άμεσα με την σχετική ένδειξη, το δε χειρουργείο πρέπει να είναι ριζικό (ολική θυρεοειδεκτομή) και θα πρέπει να συμπεριλαμβάνεται σε αυτό ο κεντρικός λεμφαδενικός καθαρισμός ή και πλάγιος μετά από θετική βιοψία των ύποπτων λεμφαδένων.
Διαχείριση των διηθημένων γειτονικών δομών
Ο θεραπευτικός σχεδιασμός θα πρέπει να ξεκινά προεγχειρητικά με την υποψία ή την διάγνωση της διήθησης. Παράλληλα με το πλήρες ιατρικό ιστορικό απαιτείται λεπτομερής υπερηχογραφικός έλεγχος από έμπειρο ακτινολόγο σε συνδυασμό με FNA, που μπορεί να συμπληρώνεται από αξονική/μαγνητική τομογραφία, PET, λαρυγγοσκόπηση, οισοφαγοσκόπηση και βρογχοσκόπηση, ώστε να τεκμηριωθεί ενδεχόμενη διήθηση των γειτονικών οργάνων. Ενδείξεις διήθησης μπορεί να προκύψουν από τα συμπτώματα του ασθενούς, όπως το άλγος, η ταχεία αύξηση του μεγέθους, το βράγχος φωνής, η δύσπνοια, η δυσφαγία και η αιμόπτυση αλλά και από την κλινική εξέταση όταν ψηλαφάται μια σκληρή καθηλωμένη μάζα, όταν υπάρχει σύνδρομο άνω κοίλης και σύνδρομο Horner ή δερματικό συρίγγιο. Η αξιολόγηση της κινητικότητας των φωνητικών χορδών παρέχει πληροφορίες για τυχόν πάρεση, η οποία υποδηλώνει διήθηση του λαρυγγικού νεύρου, οπότε και θα πρέπει να ενημερωθεί κατάλληλα ο ασθενής. Θα πρέπει να σημειωθεί ότι 15% των ασθενών με βράγχος φωνής πριν το χειρουργείο παρουσιάζουν ομαλή λειτουργία των φωνητικών χορδών. Όταν τεκμηριωθεί παράλυση της φωνητικής χορδής με ακινησία, γίνεται en block εκτομή του διηθημένου παλίνδρομου λαρυγγικού νεύρου με τον όγκο, διασφαλίζοντας όμως την ακεραιότητα της υγιούς πλευράς. Στην περίπτωση που προεγχειρητικά υπάρχει καλή κινητικότητα της φωνητικής χορδής, ενώ διαπιστώνεται διεγχειρητικά διήθηση του παλίνδρομου λαρυγγικού, θα μπορούσε να γίνει προσπάθεια διάσωσης του νεύρου με απόξεση (shaving) του όγκου, που μπορεί να συμπληρωθεί μετεγχειρητικά με ραδιενεργό ιώδιο ή/και ακτινοθεραπεία.
Όταν υπάρχει διήθηση του παλίνδρομου λαρυγγικού νεύρου, η πρόγνωση δεν εξαρτάται από την επάρκεια της αφαίρεσης αλλά από την παρουσία απομακρυσμένων μεταστάσεων ή αν έχει γίνει R1 εκτομή στην διήθηση παρακείμενων οργάνων. Ο μόνος τρόπος βελτίωσης της πρόγνωση είναι η R0 εκτομή, με τα ποσοστά 5ετούς επιβίωσης να είναι 74% στην R0, 39% στην R1 και 33% στην R2 αντίστοιχα.
Ωστόσο οι εκτεταμένες επεμβάσεις συνοδεύονται από μεγαλύτερα ποσοστά νοσηρότητας και θνητότητας. Θα πρέπει να προηγείται ενδελεχής αξιολόγηση της κατάστασης του ασθενούς, να αποκλειστούν οι απομακρυσμένες μεταστάσεις, να είναι εξαιρέσιμη η νόσος, να υπάρχει η κατάλληλη εμπειρία από όλες τις χειρουργικές ειδικότητες που θα εμπλακούν και η κατάλληλη υποστηρικτική υποδομή. Η προσπάθεια της ριζικής χειρουργικής θεραπείας θα πρέπει να γίνεται με γνώμονα όχι μόνο την επιβίωση του ασθενούς αλλά και την μετέπειτα ποιότητα της ζωής. Εναλλακτικά θα μπορούσαν να χρησιμοποιηθούν τεχνικές κατάλυσης (ablation) και τοποθέτηση stent, ακτινοθεραπεία μόνη της ή σε συνδυασμό με χημειοθεραπεία. Τα τελευταία χρόνια έχει προταθεί η προεγχειρητική (neoadjuvant) ακτινοθεραπεία και χημειοθεραπεία με σκοπό την βελτιστοποίηση του χειρουργικού αποτελέσματος.
Επικουρική θεραπεία με ραδιενεργό ιώδιο 131 για τα επιθετικά PTC
 Τα νεοπλάσματα με μέγεθος <4 cm που περιορίζονται στο θυρεοειδή αδένα (Τ1 και T2N0M0) θεωρούνται χαμηλού κινδύνου για υποτροπή. Επίσης, χαμηλό κίνδυνο υποτροπής (<5%) εμφανίζουν και ασθενείς με λιγότερες από 4 εστίες διήθησης σε αγγεία (ελάχιστα διηθητικό θηλώδες καρκίνωμα) καθώς και με λιγότερες από 5 μικροσκοπικές μεταστατικές εστίες σε επιχώριους λεμφαδένες. Oι όγκοι αυτοί αντιμετωπίζονται με χειρουργική αφαίρεση και δεν χρειάζονται συμπληρωματική θεραπεία με ραδιενεργό ιώδιο, εκτός από τις περιπτώσεις του επιθετικού θηλώδους καρκινώματος.
Τα νεοπλάσματα με μέγεθος <4 cm που περιορίζονται στο θυρεοειδή αδένα (Τ1 και T2N0M0) θεωρούνται χαμηλού κινδύνου για υποτροπή. Επίσης, χαμηλό κίνδυνο υποτροπής (<5%) εμφανίζουν και ασθενείς με λιγότερες από 4 εστίες διήθησης σε αγγεία (ελάχιστα διηθητικό θηλώδες καρκίνωμα) καθώς και με λιγότερες από 5 μικροσκοπικές μεταστατικές εστίες σε επιχώριους λεμφαδένες. Oι όγκοι αυτοί αντιμετωπίζονται με χειρουργική αφαίρεση και δεν χρειάζονται συμπληρωματική θεραπεία με ραδιενεργό ιώδιο, εκτός από τις περιπτώσεις του επιθετικού θηλώδους καρκινώματος.
Οι επιθετικοί υπότυποι του θηλώδους καρκινώματος οι οποίοι θεωρούνται υψηλού κινδύνου για υποτροπή είναι οι εξής:
- Ο υπότυπος από υψηλά κύτταρα (tall cell variant) που συχνά σχετίζεται με ύπαρξη της μετάλλαξης V600E του γονιδίου BRAF
- Ο υπότυπος από κυλινδρικά κύτταρα (Columnar cell CCV)
- Ο συμπαγής τύπος (Solid/Trabecular – SVPTC)
- Ο διάχυτος σκληρυντικός υπότυπος (diffuse sclerosing variant) που χαρακτηρίζεται από ίνωση του στρώματος και εκτεταμένη λεμφοκυτταρική διήθηση.
- Ο υπότυπος «hobnail», ο οποίος εμφανίζει συχνά μεταλλάξεις του BRAF V600E3.
Ιδιαίτερη μνεία αξίζει να γίνει για τα μη διηθητικά εγκαψωμένα θηλώδη καρκινώματα, τα οποία συνήθως έχουν μέγεθος 2 – 4 cm και λόγω του πολύ χαμηλού κακοήθους δυναμικού, αντιμετωπίζονται ως νεοπλάσματα και όχι ως κακοήθειες. Αυτά χαρακτηρίζονται ως μη διηθητικά θυλακιώδη θυρεοειδικά νεοπλάσματα με θηλώδη πυρηνική μορφολογία (noninvasive follicular thyroidneoplasm with papillary-like nuclear features, NIFTP).
Είναι εξαιρετικής σημασίας ο ασφαλής καθορισμός των ασθενών με χαμηλό κίνδυνο υποτροπής για τον οποίο είναι απαραίτητες οι παρακάτω προϋποθέσεις:
Από την χειρουργική ομάδα: Προεγχειρητική εκτίμηση με αξιόπιστο υπερηχογράφημα τραχήλου για προγραμματισμό της ενδεδειγμένης εγχειρητικής προσέγγισης (θυρεοειδεκτομή ± λεμφαδενικός καθαρισμός ανάλογης έκτασης).
Από το παθολογοανατομικό εργαστήριο. Εξέταση όλου του όγκου ώστε να μη διαφύγει διήθηση και διάσπαση της κάψας, ειδικά σε όγκους με σχετικά μεγάλο μέγεθος. Η ιστολογική έκθεση δέον να περιγράφει με λεπτομέρεια και σαφήνεια την μακροσκοπική όψη του παρασκευάσματος, τους κυτταρικούς υπότυπους, τα ανοσοϊστοχημικά ευρήματα, την ύπαρξη λεμφαδένων στο παρασκεύασμα και την έκταση της διήθησης από το καρκίνωμα
Από τον ενδοκρινολόγο. Γίνεται προσεκτική εκτίμηση της ιστολογικής έκθεσης για την αξιολόγηση του κινδύνου υποτροπής, η μέτρηση της θυρεοσφαιρίνης ορού 1 μήνα μετά το χειρουργείο και κατά προτίμηση με διακοπή της ορμονικής θεραπείας υποκατάστασης (δηλαδή με TSH >30-40 μIU/ml). Με την μέτρηση αυτή αφενός εκτιμάται το μέγεθος του θυρεοειδικού υπολείμματος και αφετέρου αποκαλύπτεται η μεταστατική νόσος που είχε διαφύγει από τον προεγχειρητικό και διεγχειρητικό έλεγχο. Έτσι, θυρεοσφαιρίνη μέχρι 10 – 15 ng/ml, είναι συμβατή με φυσιολογικό υπόλειμμα θυρεοειδικού ιστού και ο ασθενής τίθεται σε ορμονική θεραπεία υποκατάστασης με θυροξίνη χωρίς άλλο εργαστηριακό έλεγχο. Αν η θυρεοσφαιρίνη είναι υψηλότερη θα πρέπει ο ασθενής να υποβληθεί σε απεικονιστικό έλεγχο (U/S τραχήλου, σπινθηρογράφημα, CT θώρακα) αναλόγως των επιπέδων της για εντοπισμό της προέλευσης της, επαναπροσδιορισμό του κινδύνου υποτροπής και ανάλογη αντιμετώπιση.
Για την περαιτέρω παρακολούθηση του ασθενούς με θυρεοειδικό καρκίνο χαμηλού κινδύνου για υποτροπή, ο οποίος δεν έλαβε ραδιενεργό ιώδιο 131 εγείρονται δύο κρίσιμα ερωτήματα:
- Είναι αξιόπιστος ο προσδιορισμός της θυρεοσφαιρίνης;
- Είναι αξιόπιστο το υπερηχογράφημα θυρεοειδούς;
Η θυρεοσφαιρίνη στους ασθενείς αυτούς (μετρημένη μάλιστα χωρίς διακοπή της αγωγής με θυροξίνη) εμφανίζει σταδιακή μείωση σε 2-4 χρόνια μετεγχειρητικά. Επιπλέον, η αύξηση των επιπέδων της θυρεοσφαιρίνης (πάντα υπό αγωγή) στην πορεία παρακολούθησης των ασθενών αυτών υποδηλώνει υποτροπή της νόσου, εύρημα που δείχνει ότι η θυρεοσφαιρίνη παραμένει δείκτης παρακολούθησης με εξαιρετική ευαισθησία και ειδικότητα. Κατά συνέπεια η παρακολούθηση των ασθενών οι οποίοι δεν έλαβαν επικουρική θεραπεία με ραδιενεργό ιώδιο 131, γίνεται με μέτρηση α) της TSH (για τον έλεγχο της θεραπείας υποκατάστασης που τιτλοποιείται με στόχο τιμή της TSH 0,5 – 2μ IU/ml) και β) της θυρεοσφαιρίνης υπό αγωγή υποκατάστασης για εκτίμηση τυχόν υποτροπής. Προφανώς προσδιορίζονται και τα αντι-θυρεοσφαιρινικά αντισώματα για την ορθότερη εκτίμηση της θυρεοσφαιρίνης. Το υπερηχογράφημα τραχήλου επιβάλλεται σε επίμονη αύξηση της θυρεοσφαιρίνης. Έχει εξαιρετική σημασία να αποφεύγεται υπερεκτίμηση των υπερηχογραφικών ευρημάτων (μικρού θυρεοειδικού υπολείμματος και λεμφαδένων) επί σταθερών επιπέδων θυρεοσφαιρίνης της τάξεως 5 – 10ng/ml. Η εμπειρία δείχνει ότι η μηδενική θυρεοσφαιρίνη και το αρνητικό υπερηχογράφημα δεν είναι αυτοσκοπός και επιπλέον η σταθερή /ελάχιστη νόσος δεν επηρεάζει την νοσηρότητα και βεβαίως την θνητότητα. Αντίθετα, επίμονοι και επίπονοι έλεγχοι για εντοπισμό της εστίας παραγωγής των σταθερά μετρήσιμων επιπέδων θυρεοσφαιρίνης της τάξεως που προαναφέρθηκε, ταλαιπωρούν τους ασθενείς με μηδενικό όφελος.
Θυλακιώδες καρκίνωμα
 Ο θυλακιώδης θυρεοειδικός καρκίνος (Follicular Thyroid Cancer / FTC) είναι η δεύτερη κατηγορία των καλά διαφοροποιημένων καρκίνων του θυρεοειδούς. Όλοι οι τύποι των θηλωδών, θυλακιωδών και μικτών θηλωδών – θυλακιωδών καρκίνων απαρτίζουν το 90% όλων των καρκίνων του θυρεοειδούς. Τα αμιγώς θυλακιώδη καρκινώματα αποτελούν το 20% των καρκίνων του θυρεοειδούς και εμφανίζονται συνηθέστερα σε περιοχές με έλλειψη ιωδίου. Η συνολική επίπτωση αυτού του όγκου έχει μειωθεί παγκοσμίως ως αποτέλεσμα της αναπλήρωσης του ιωδίου και της βελτιωμένης ιστολογικής ταξινόμησης. Μολονότι μπορεί να εμφανισθεί σε οποιαδήποτε ηλικία, συνήθως αφορά ασθενείς μεγαλύτερης ηλικίας σε σχέση με το θηλώδες καρκίνωμα. Εμφανίζεται συνήθως κατά την 6η δεκαετία της ζωής και η αναλογία γυναικών : ανδρών κυμαίνεται από 2:1 έως 5:1.
Ο θυλακιώδης θυρεοειδικός καρκίνος (Follicular Thyroid Cancer / FTC) είναι η δεύτερη κατηγορία των καλά διαφοροποιημένων καρκίνων του θυρεοειδούς. Όλοι οι τύποι των θηλωδών, θυλακιωδών και μικτών θηλωδών – θυλακιωδών καρκίνων απαρτίζουν το 90% όλων των καρκίνων του θυρεοειδούς. Τα αμιγώς θυλακιώδη καρκινώματα αποτελούν το 20% των καρκίνων του θυρεοειδούς και εμφανίζονται συνηθέστερα σε περιοχές με έλλειψη ιωδίου. Η συνολική επίπτωση αυτού του όγκου έχει μειωθεί παγκοσμίως ως αποτέλεσμα της αναπλήρωσης του ιωδίου και της βελτιωμένης ιστολογικής ταξινόμησης. Μολονότι μπορεί να εμφανισθεί σε οποιαδήποτε ηλικία, συνήθως αφορά ασθενείς μεγαλύτερης ηλικίας σε σχέση με το θηλώδες καρκίνωμα. Εμφανίζεται συνήθως κατά την 6η δεκαετία της ζωής και η αναλογία γυναικών : ανδρών κυμαίνεται από 2:1 έως 5:1.
Παθολογοανατομία
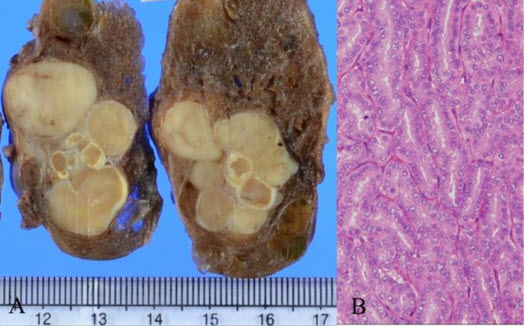 Το FTC αναπτύσσεται από το θυρεοειδικό επιθήλιο και παρουσιάζει ένα ευρύ φάσμα μικροσκοπικών αλλαγών, που κυμαίνεται από την κανονική θυλακιώδη αρχιτεκτονική μέχρι την βαριά διαταραγμένη κυτταρική δομή. Είναι τα πιο διαφοροποιημένα, τόσο ώστε ιστολογικά πολλές φορές δεν ξεχωρίζουν από το φυσιολογικό θυρεοειδικό ιστό. Παρά την αθώα τους ιστολογική εμφάνιση δίνουν αιματογενείς μεταστάσεις στους πνεύμονες και στο σκελετό. Τα θυλακιώδη καρκινώματα είναι συνήθως συμπαγείς βλάβες που στην πλειονότητά τους περιβάλλονται από κάψα. Ιστολογικά διακρίνονται θυλάκια, αλλά ο αυλός τους στερείται κολλοειδούς. Τα αρχιτεκτονικά πρότυπα εξαρτώνται από τον βαθμό διαφοροποίησης του όγκου.
Το FTC αναπτύσσεται από το θυρεοειδικό επιθήλιο και παρουσιάζει ένα ευρύ φάσμα μικροσκοπικών αλλαγών, που κυμαίνεται από την κανονική θυλακιώδη αρχιτεκτονική μέχρι την βαριά διαταραγμένη κυτταρική δομή. Είναι τα πιο διαφοροποιημένα, τόσο ώστε ιστολογικά πολλές φορές δεν ξεχωρίζουν από το φυσιολογικό θυρεοειδικό ιστό. Παρά την αθώα τους ιστολογική εμφάνιση δίνουν αιματογενείς μεταστάσεις στους πνεύμονες και στο σκελετό. Τα θυλακιώδη καρκινώματα είναι συνήθως συμπαγείς βλάβες που στην πλειονότητά τους περιβάλλονται από κάψα. Ιστολογικά διακρίνονται θυλάκια, αλλά ο αυλός τους στερείται κολλοειδούς. Τα αρχιτεκτονικά πρότυπα εξαρτώνται από τον βαθμό διαφοροποίησης του όγκου.
Μικροσκοπικά το FTC είναι δύσκολο να διακριθεί από το φυσιολογικό θυρεοειδικό ιστό. Η ιστολογική τεκμηρίωση της κακοήθειας γίνεται με βάση την διήθηση της κάψας, των λεμφαγγείων και των αγγείων του αδένα. Εάν τα καλά διαφοροποιημένα θυλακιώδη κύτταρα δεν διηθούν αυτές τις ανατομικές δομές, τότε μιλάμε για καλόηθες θυλακιώδες αδένωμα.
Η ταυτοποίηση, επομένως, ενός θυλακιώδους νεοπλάσματος ως καρκίνου γίνεται με κριτήριο την διήθηση της κάψας και των αγγείων του θυρεοειδούς αδένα από τα νεοπλασματικά κύτταρα κατά την ιστολογική εξέταση του χειρουργικού παρασκευάσματος. Αυτός είναι και ο λόγος που δεν μπορεί να γίνει ασφαλής διάκριση μεταξύ του θυλακιώδους αδενώματος και του θυλακιώδους καρκίνου με την ταχεία βιοψία ή την FNAΒ. Για τους λόγους αυτούς, η προεγχειρητική κυτταρολογική εξέταση με FNAΒ και η ταχεία βιοψία κατά την πορεία της επέμβασης έχουν περιορισμένη διαγνωστική αξία, αφού με αυτές δεν μπορεί να αξιολογηθεί η παρουσία της διήθησης της κάψας ή των αγγείων.
Για τον ίδιο λόγο, επί απουσίας μεταστατικής νόσου είναι δύσκολο να εκτιμηθεί προεγχειρητικά, εάν ένας μονήρης θυρεοειδικός όζος είναι θυλακιώδες αδένωμα ή θυλακιώδες καρκίνωμα. Ωστόσο, κατά κανόνα οι ασθενείς με θυρεοειδικό όζο υποβάλλονται σε FNAB. Περίπου το 20% των ασθενών, που η FNAB έδειξε θυλακιώδες αδένωμα, θα πάσχουν τελικά από FTC. Για την οριστική διάκριση μεταξύ του καλοήθους θυλακιώδους αδενώματος και του κακοήθους θυλακιώδους καρκινώματος, γίνεται διεξοδική ιστολογική εξέταση του χειρουργικού παρασκεύασματος και ελέγχεται η κατάσταση της κάψας και των αγγείων. Οι ευμεγέθεις θυλακιώδεις όγκοι (>4cm), ειδικά στους ηλικιωμένους άνδρες, συνήθως είναι κακοήθεις.
Οι ελάχιστα διηθητικοί όγκοι εμφανίζονται μακροσκοπικά ενδοκαψικά, αλλά μικροσκοπικά φαίνεται σαφώς διήθηση της κάψας του θυρεοειδούς αδένα ή/και των αγγείων. Από την άλλη, οι ευρέως διηθητικοί όγκοι χαρακτηρίζονται από εκτεταμένη διήθηση της κάψας ή/και των αγγείων. Η διήθηση του όγκου αλλά και η διείσδυση των νεοπλασματικών εμβόλων μέσα στις θυρεοειδικές φλέβες μπορεί να είναι ευδιάκριτα κατά την επέμβαση.
Δυσμενείς προγνωστικοί παράγοντες των θυλακιωδών καρκινωμάτων θεωρούνται οι εξής: 1) η παρουσία μεταστατικής νόσου, 2) ηλικία άνω των 40 ετών, 3) η διήθηση της κάψας ή/και των αγγείων του αδένα, και 4) ο χαμηλός βαθμός διαφοροποίησης των καρκινικών κυττάρων.
Κλινική εικόνα
 Το FTC συνήθως παρουσιάζεται ως ένας βραδέως αναπτυσσόμενος μονήρης ανώδυνος όζος και κατά την ψηλάφηση παρουσιάζει ελαστικά ή ακόμη και μαλακά στοιχεία. Ο πόνος είναι ασυνήθης, εκτός εάν έχει συμβεί αιμορραγία μέσα στον όζο. Αν και η πολυοζώδης βρογχοκήλη αποτελεί μια καλοήθη μάζα, η συνύπαρξη θυλακιώδους καρκινώματος συμβαίνει στο 10% των ασθενών με βρογχοκήλη. Σε αντιδιαστολή με τους θηλώδεις καρκίνους, η τραχηλική λεμφαδενοπάθεια είναι ασυνήθης κατά την αρχική παρουσίαση (περίπου 5%). Σχεδόν το 25% των ασθενών παρουσιάζουν εξωθυρεοειδική διήθηση και το 22% έχουν απομακρυσμένες μεταστάσεις κατά την αρχική διάγνωση.
Το FTC συνήθως παρουσιάζεται ως ένας βραδέως αναπτυσσόμενος μονήρης ανώδυνος όζος και κατά την ψηλάφηση παρουσιάζει ελαστικά ή ακόμη και μαλακά στοιχεία. Ο πόνος είναι ασυνήθης, εκτός εάν έχει συμβεί αιμορραγία μέσα στον όζο. Αν και η πολυοζώδης βρογχοκήλη αποτελεί μια καλοήθη μάζα, η συνύπαρξη θυλακιώδους καρκινώματος συμβαίνει στο 10% των ασθενών με βρογχοκήλη. Σε αντιδιαστολή με τους θηλώδεις καρκίνους, η τραχηλική λεμφαδενοπάθεια είναι ασυνήθης κατά την αρχική παρουσίαση (περίπου 5%). Σχεδόν το 25% των ασθενών παρουσιάζουν εξωθυρεοειδική διήθηση και το 22% έχουν απομακρυσμένες μεταστάσεις κατά την αρχική διάγνωση.
Μερικές φορές, η νόσος πρωτοεκδηλώνεται με συμπτώματα από τις μακρινές μεταστάσεις στα οστά, πνεύμονες, εγκέφαλο και ήπαρ, γιατί οι όγκοι αυτοί, σε αντίθεση με τα θηλώδη καρκινώματα, μεθίστανται αιματογενώς. Οι μεταστάσεις από αυτόν τον όγκο επιδεικνύουν αυξημένη πρόσληψη του ραδιενεργού ιωδίου μετά από ολική θυρεοειδεκτομή σε ποσοστό 80%. Οι οστικές μεταστάσεις μπορεί να εμφανιστούν πολλά χρόνια μετά την αφαίρεση του πρωτοπαθούς όγκου.
Αν και το βράγχος της φωνής και η καθήλωση της νεοπλασματικής μάζας στην τραχεία δηλώνουν προχωρημένη νόσο και φτωχή πρόγνωση, αυτά τα περιστατικά είναι σπάνια. Σε αυτές τις περιπτώσεις, η επέκταση του όγκου στην τραχεία και το ενδεχόμενο της απομακρυσμένης μετάστασης ελέγχονται με την αξονική τομογραφία ή την μαγνητική τομογραφία του τραχήλου και του θώρακα.
Εργαστηριακές εξετάσεις
 Η εργαστηριακή διερεύνηση του θυλακιώδους καρκινώματος συνήθως αποκαλύπτει ένα ευθυρεοειδικό πρότυπο λειτουργίας του θυρεοειδούς αδένα. Σε ποσοστό, όμως, <1% των περιπτώσεων οι θυλακιώδεις καρκίνοι μπορεί να είναι υπερλειτουργικοί και τότε οι ασθενείς εμφανίζονται με κλινική συμπτωματολογία υπερθυρεοειδισμού ή θυρεοτοξίκωσης.
Η εργαστηριακή διερεύνηση του θυλακιώδους καρκινώματος συνήθως αποκαλύπτει ένα ευθυρεοειδικό πρότυπο λειτουργίας του θυρεοειδούς αδένα. Σε ποσοστό, όμως, <1% των περιπτώσεων οι θυλακιώδεις καρκίνοι μπορεί να είναι υπερλειτουργικοί και τότε οι ασθενείς εμφανίζονται με κλινική συμπτωματολογία υπερθυρεοειδισμού ή θυρεοτοξίκωσης.
Η σταδιοποίηση του θυλακιώδους νεοπλάσματος προεγχειρητικά γίνεται με τις απεικονιστικές εξετάσεις. Το υπερηχογράφημα προσδιορίζει με ακρίβεια το μέγεθος και την πολυεστιακότητα, αν και είναι γνωστό ότι το FTC συνήθως εμφανίζεται ως μονήρης βλάβη. Το σπινθηρογράφημα με τα ραδιονουκλεοτίδια αποκαλύπτει την λειτουργική κατάσταση της βλάβης (θερμή ή ψυχρή). Σε προχωρημένες μορφές της νόσου η εξωθυρεοειδική επέκταση και το ενδεχόμενο των απομακρυσμένων μεταστάσεων ελέγχεται με την αξονική τομογραφία ή την μαγνητική τομογραφία του τραχήλου και του θώρακα.
Θεραπεία
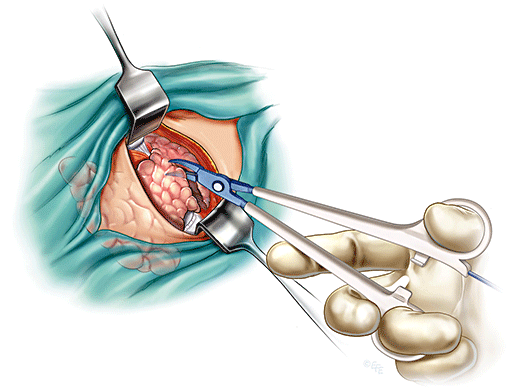 Η αντιμετώπιση του θυλακοειδούς καρκινώματος πρωτίστως είναι χειρουργική. Κατά κανόνα, οι ασθενείς παραπέμπονται στον χειρουργό με την διάγνωση μιας θυρεοειδικής βλάβης, για την οποία η FNAB έδειξε θυλακιώδες νεόπλασμα, χωρίς να είναι σαφές εάν πρόκειται για καλόηθες θυλακιώδες αδένωμα ή θυλακιώδες καρκίνωμα. Στις περιπτώσεις αυτές ο χειρουργός καλείται να αποφασίσει για την επιλογή της πιο αποτελεσματικής θεραπείας της θυλακιώδους βλάβης. Εάν η βλάβη είναι <2 cm και καλά περιγεγραμμένη μέσα σε ένα λοβό του θυρεοειδούς, η επικρατούσα άποψη είναι να γίνει λοβεκτομή με ισθμεκτομή, διότι το 80% από αυτές αφορούν καλοήθη αδενώματα. Κατά την εξέλιξη της επέμβασης η παθολογοανατομική εξέταση της βλάβης θα διασαφηνίσει εάν υπάρχει διήθηση της κάψας και των αγγείων. Επί θετικών ευρημάτων οριστικοποιείται η διάγνωση του καρκίνου και πραγματοποιείται ολική θυρεοειδεκτομή. Να σημειωθεί ότι ορισμένοι χειρουργοί και στις περιπτώσεις αυτές προτείνουν από την αρχή ολική θυρεοειδεκτομή. Σε περίπτωση λοβεκτομής είναι φρόνιμο κατά την πορεία της αρχικής επέμβασης ο χειρουργός να μην προβαίνει σε χειρισμούς στον ετερόπλευρο λοβό, αφήνοντας το πεδίο ανέπαφο για ενδεχόμενη μελλοντική επανεπέμβαση.
Η αντιμετώπιση του θυλακοειδούς καρκινώματος πρωτίστως είναι χειρουργική. Κατά κανόνα, οι ασθενείς παραπέμπονται στον χειρουργό με την διάγνωση μιας θυρεοειδικής βλάβης, για την οποία η FNAB έδειξε θυλακιώδες νεόπλασμα, χωρίς να είναι σαφές εάν πρόκειται για καλόηθες θυλακιώδες αδένωμα ή θυλακιώδες καρκίνωμα. Στις περιπτώσεις αυτές ο χειρουργός καλείται να αποφασίσει για την επιλογή της πιο αποτελεσματικής θεραπείας της θυλακιώδους βλάβης. Εάν η βλάβη είναι <2 cm και καλά περιγεγραμμένη μέσα σε ένα λοβό του θυρεοειδούς, η επικρατούσα άποψη είναι να γίνει λοβεκτομή με ισθμεκτομή, διότι το 80% από αυτές αφορούν καλοήθη αδενώματα. Κατά την εξέλιξη της επέμβασης η παθολογοανατομική εξέταση της βλάβης θα διασαφηνίσει εάν υπάρχει διήθηση της κάψας και των αγγείων. Επί θετικών ευρημάτων οριστικοποιείται η διάγνωση του καρκίνου και πραγματοποιείται ολική θυρεοειδεκτομή. Να σημειωθεί ότι ορισμένοι χειρουργοί και στις περιπτώσεις αυτές προτείνουν από την αρχή ολική θυρεοειδεκτομή. Σε περίπτωση λοβεκτομής είναι φρόνιμο κατά την πορεία της αρχικής επέμβασης ο χειρουργός να μην προβαίνει σε χειρισμούς στον ετερόπλευρο λοβό, αφήνοντας το πεδίο ανέπαφο για ενδεχόμενη μελλοντική επανεπέμβαση.
Εάν η θυλακιώδης βλάβη είναι >2 cm πραγματοποιείται εξ αρχής ολική θυρεοειδεκτομή, ειδικά αν η βλάβη είναι >4 cm, επειδή ο κίνδυνος για καρκίνο υπερβαίνει το 50%.
Στον ελάχιστα διηθητικό FTC υπάρχει μικροδιήθηση της κάψας χωρίς διήθηση των αγγείων. Αυτά έχουν εξαιρετικά καλή πρόγνωση, όμοια με εκείνη του θηλώδους μικροκαρκινώματος. Ωστόσο, υπάρχουν διιστάμενες απόψεις μεταξύ των ερευνητών αναφορικά με το εάν οι ασθενείς με ελάχιστα διηθητικούς θυλακιώδεις καρκίνους θα πρέπει να υποβάλλονται σε ολική θυρεοειδεκτομή. Αν ο άρρωστος έχει ήδη υποβληθεί μόνο σε λοβεκτομή και η διάγνωση της μικροδιήθησης τεθεί μετεγχειρητικά, αυτή θεωρείται επαρκής και δεν χρειάζεται συμπληρωματική εγχείρηση ή επικουρική θεραπεία με ραδιενεργό ιώδιο-131.
Η ολική θυρεοειδεκτομή είναι επιβεβλημένη σε ασθενείς με διήθηση των αγγείων. Εφόσον δεν υπάρχουν διογκωμένοι λεμφαδένες, δεν συστήνεται ο προληπτικός λεμφαδενικός καθαρισμός, επειδή οι μεταστάσεις στους τραχηλικούς λεμφαδένες συμβαίνουν σπάνια. Εάν όμως ο κλινικοεργαστηριακός έλεγχος δείξει την παρουσία λεμφαδενικών μεταστάσεων τότε πραγματοποιείται τροποποιημένος λεμφαδενικός καθαρισμός του τραχήλου.
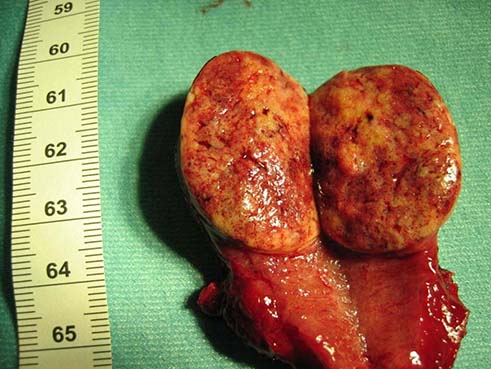 Ένα ιδιαίτερα πιεστικό δίλημμα αναφύεται στην περίπτωση που κάποιος ασθενής έχει υποβληθεί σε λοβεκτομή του θυρεοειδούς για βλάβη, που αρχικά είχε εκληφθεί ως καλόηθες θυρεοειδικό αδένωμα, αλλά η τελική παθολογοανατομική εξέταση αναδεικνύει FTC. Στις περιπτώσεις αυτές η τελική απόφαση διαμορφώνεται σύμφωνα με τα ακόλουθα κριτήρια: α) αν η βλάβη θεωρηθεί χαμηλού κινδύνου (μικρό μέγεθος, νεαροί ασθενείς), ο ασθενής παρακολουθείται υπερηχογραφικά κάθε 6 μήνες και μετριέται η θυρεοσφαιρίνη και β) αν η βλάβη κριθεί υψηλού κινδύνου (μέγεθος >2cm, ασθενής >60 ετών) απαιτείται συμπληρωματική θεραπεία με ραδιενεργό ιώδιο. Συνήθως, η δεύτερη κατηγορία ασθενών απαιτεί επανεπέμβαση για την ολοκλήρωση της ολικής θυρεοειδεκτομής, η οποία όμως συνδυάζεται με αυξημένες τεχνικές δυσκολίες και υψηλή πιθανότητα επιπλοκών. Ο καλύτερος τρόπος για να αποφευχθεί ένα τέτοιο δίλημμα είναι να μελετηθεί προσεκτικά από έμπειρο παθολογοανατόμο η νεοπλασματική αλλοίωση και να εκτελεστεί από την αρχή η ενδεδειγμένη χειρουργική επέμβαση, εξατομικευμένα για κάθε περίσταση. Ωστόσο, θα πρέπει να αντισταθμιστούν τα οφέλη και τα μειονεκτήματα μιας αρχικής εκτεταμένης χειρουργικής επέμβασης με εκείνα της επανεπέμβασης σε μεταγενέστερο χρόνο για την ολοκλήρωση της ολικής θυρεοειδεκτομής.
Ένα ιδιαίτερα πιεστικό δίλημμα αναφύεται στην περίπτωση που κάποιος ασθενής έχει υποβληθεί σε λοβεκτομή του θυρεοειδούς για βλάβη, που αρχικά είχε εκληφθεί ως καλόηθες θυρεοειδικό αδένωμα, αλλά η τελική παθολογοανατομική εξέταση αναδεικνύει FTC. Στις περιπτώσεις αυτές η τελική απόφαση διαμορφώνεται σύμφωνα με τα ακόλουθα κριτήρια: α) αν η βλάβη θεωρηθεί χαμηλού κινδύνου (μικρό μέγεθος, νεαροί ασθενείς), ο ασθενής παρακολουθείται υπερηχογραφικά κάθε 6 μήνες και μετριέται η θυρεοσφαιρίνη και β) αν η βλάβη κριθεί υψηλού κινδύνου (μέγεθος >2cm, ασθενής >60 ετών) απαιτείται συμπληρωματική θεραπεία με ραδιενεργό ιώδιο. Συνήθως, η δεύτερη κατηγορία ασθενών απαιτεί επανεπέμβαση για την ολοκλήρωση της ολικής θυρεοειδεκτομής, η οποία όμως συνδυάζεται με αυξημένες τεχνικές δυσκολίες και υψηλή πιθανότητα επιπλοκών. Ο καλύτερος τρόπος για να αποφευχθεί ένα τέτοιο δίλημμα είναι να μελετηθεί προσεκτικά από έμπειρο παθολογοανατόμο η νεοπλασματική αλλοίωση και να εκτελεστεί από την αρχή η ενδεδειγμένη χειρουργική επέμβαση, εξατομικευμένα για κάθε περίσταση. Ωστόσο, θα πρέπει να αντισταθμιστούν τα οφέλη και τα μειονεκτήματα μιας αρχικής εκτεταμένης χειρουργικής επέμβασης με εκείνα της επανεπέμβασης σε μεταγενέστερο χρόνο για την ολοκλήρωση της ολικής θυρεοειδεκτομής.
Η μετεγχειρητική θεραπεία με Τ4 βασίζεται στην εδραία υπόθεση ότι η καταστολή της TSH ελαχιστοποιεί την τροφική δράση στον θυρεοειδικό καρκίνο. Πράγματι, τα δεδομένα της κλινικής έρευνας πιστοποιούν ότι η εντατική θεραπεία με Τ4 έχει καταφανή θετικά αποτελέσματα στην υποτροπή του θυλακιώδους καρκινώματος, αλλά, όμως, συνοδεύεται από σημαντική αύξηση των οστεοπορωτικών παρενεργειών.
Αναφορικά με την θεραπεία με ραδιενεργό ιώδιο στον θυλακιώδη καρκίνο, δεν φαίνεται να υπάρχει ουσιαστικό όφελος στους ασθενείς που έχει γίνει ριζική αφαίρεση της βλάβης με ολική θυρεοειδεκτομή ή σε πρώιμα στάδια της νόσου. Είναι γνωστό άλλωστε ότι η θεραπεία με ραδιονουκλεοτίδια είναι πιο αποτελεσματική στους ασθενείς που έχουν υποβληθεί σε ολική θυρεοειδεκτομή. Σε ασθενείς που έχουν υποβληθεί σε υφολική θυρεοειδεκτομή ή λοβεκτομή με ισθμεκτομή, απαιτούνται μεγάλες δόσεις του ραδιενεργού ιωδίου για να καταλυθεί ο υπολειμματικός θυρεοειδικός ιστός.
Η θεραπευτική χρήση του ραδιενεργού ιωδίου μετεγχειρητικά αποδίδει στα πιο προχωρημένα στάδια του θυλακιώδους καρκινώματος. Το εκτεταμένο διηθητικό FTC απαιτεί οπωσδήποτε την πραγματοποίηση ολικής θυρεοειδεκτομής, με το πλεονέκτημα της χρήσης του ραδιενεργού ιωδίου-131 για την ανίχνευση και την κατάλυση ενδεχόμενης μεταστατικής νόσου. Θεραπευτικά χορηγείται ραδιενεργό ιώδιο-131 σε δόση 50-150mCi για να καταστραφούν όλες οι υπολειμματικές εστίες. Η χορήγηση ραδιενεργού ιωδίου-131 είναι επίσης απαραίτητη σε μεταστάσεις που προσλαμβάνουν ιώδιο, οπότε χορηγούνται δόσεις μεγαλύτερες των 100-200 mCi. Επιπλέον, η θεραπεία με ραδιενεργό ιώδιο είναι χρήσιμη στους ηλικιωμένους ασθενείς (>75 ετών) και στους ασθενείς των οποίων τα επίπεδα θυρεοσφαιρίνης αυξάνουν 3 μήνες μετά την χειρουργική επέμβαση.
Παρακολούθηση – Πρόγνωση
Μετά την θεραπεία ο ασθενής παρακολουθείται εντατικά, συνήθως κάθε 6 μήνες. Εκτός από την κλινική εξέταση μετριέται και η θυρεοσφαιρίνη στον ορό. Οι υψηλές τιμές θυρεοσφαιρίνης μετά από θυρεοειδεκτομή υποδηλώνουν ύπαρξη υπολειμματικού θυρεοειδικού νεοπλασματικού ιστού. Τότε γίνονται ειδικές απεικονιστικές εξετάσεις ανάλογα με την περίπτωση.
Η πρόγνωση των θυλακιωδών καρκινωμάτων είναι ελαφρά χειρότερη από αυτή των θηλωδών, αν και αυτή η διαφορά είναι πιο εμφανής μετά από 10 – 15 έτη. Η πρόγνωση μετά την θεραπεία του FTCεξαρτάται από την ηλικία. Οι ασθενείς που είναι νεότεροι των 40 ετών έχουν την καλύτερη πρόγνωση, πλησιάζοντας το 95% σε 10ετή επιβίωση. Η συνολική θνητότητα λόγω FTC είναι 15% στα 10 χρόνια και 30% στα 20 έτη. Σε αντίθεση με το θηλώδες καρκίνωμα, το FTC που δεν υποτροπίασε εντός 12ετίας από την αρχική επέμβαση, θεωρείται πλήρως θεραπευμένο και επομένως η δια βίου παρακολούθηση δεν είναι απαραίτητη.
Διαχείριση ασθενούς με διαφοροποιημένο καρκίνωμα μετά την θυρεοειδεκτομή
 Το θηλώδες καρκίνωμα του θυρεοειδούς υποτροπιάζει ή εμμένει σε ποσοστό 25% των ασθενών. Το 80% των υποτροπών συμβαίνουν στον τράχηλο. Η υποτροπή συνήθως εκδηλώνεται εντός της πρώτης διετίας μετά την θυρεοειδεκτομή, αν και έχει καταγραφεί υποτροπή ακόμη και 45 έτη μετά την αρχική επέμβαση. Πρακτικά, όλες οι υποτροπές του FTC συμβαίνουν εντός 12ετίας από την αρχική επέμβαση. Το FTC που δεν υποτροπίασε εντός 12ετίας από την αρχική επέμβαση θεωρείται πλήρως ιαθέν.
Το θηλώδες καρκίνωμα του θυρεοειδούς υποτροπιάζει ή εμμένει σε ποσοστό 25% των ασθενών. Το 80% των υποτροπών συμβαίνουν στον τράχηλο. Η υποτροπή συνήθως εκδηλώνεται εντός της πρώτης διετίας μετά την θυρεοειδεκτομή, αν και έχει καταγραφεί υποτροπή ακόμη και 45 έτη μετά την αρχική επέμβαση. Πρακτικά, όλες οι υποτροπές του FTC συμβαίνουν εντός 12ετίας από την αρχική επέμβαση. Το FTC που δεν υποτροπίασε εντός 12ετίας από την αρχική επέμβαση θεωρείται πλήρως ιαθέν.
Όλοι οι ασθενείς με ιστορικό καλώς διαφοροποιημένου καρκίνου θυρεοειδούς παρακολουθούνται ετησίως με υπερηχογράφημα τραχήλου και μέτρηση των επιπέδων θυρεοσφαιρίνης και των αντιθυρεοσφαιρινικών αντισωμάτων. Η ορθή παρακολούθηση για πιθανή υποτροπή και η χορήγηση θεραπείας σε ασθενείς που μέχρι εκείνη την στιγμή εθεωρούντο ελεύθεροι νόσου, αποτελεί τον κύριο στόχο της μετεγχειρητικής παρακολούθησης.
Η παρακολούθηση είναι διαφορετική για τους ασθενείς χαμηλού, ενδιάμεσου και υψηλού κινδύνου, που πάσχουν από εμμένουσα ή υποτροπιάζουσα νόσο. Ως χαμηλού κινδύνου χαρακτηρίζονται οι ασθενείς με: α) απουσία τοπικών ή απομακρυσμένων μεταστάσεων, β) πλήρη αφαίρεση του νεοπλάσματος το οποίο εντοπιζόταν εντός των ορίων του θυρεοειδούς (R0), γ) απουσία επιθετικής ιστολογικής εικόνας και δ) απουσία πρόσληψης του ραδιενεργού ιωδίου εκτός της θυρεοειδικής κοίτης. Ως ενδιάμεσου κινδύνου χαρακτηρίζονται οι ασθενείς με μικροσκοπική διήθηση του χαλαρού συνδετικού ιστού πέριξ του αδένα ή αυτοί που έχουν όγκο με ιστολογικά στοιχεία εξωκαψικής ή αγγειακής διήθησης. Ως υψηλού κινδύνου χαρακτηρίζονται οι ασθενείς με μακροσκοπική διήθηση της κάψας, ατελή εκτομή του όγκου (R1), απομακρυσμένες μεταστάσεις ή με πρόσληψη του ραδιενεργού ιωδίου εκτός των ορίων του θυρεοειδούς στο σπινθηρογράφημα.
Θυρεοειδική ορμόνη και καταστολή της TSH
Η θυροξίνη (Τ4) είναι απαραίτητη όχι μόνο για την ορμονική θεραπεία υποκατάστασης στους ασθενείς που έχουν υποβληθεί σε ολική ή υφολική θυρεοειδεκτομή, αλλά έχει και την επιπλέον δράση να καταστέλλει την TSH και να μειώνει το ερέθισμα της ανάπτυξης στα εναπομείναντα καρκινικά κύτταρα του θυρεοειδούς. Η TSH είναι γνωστό ότι είναι τροφικός παράγοντας για τους διαφοροποιημένους καρκίνους και διεγείρει την ανάπτυξη του όγκου, την διήθηση, την αγγειογένεση και την έκκριση θυρεοσφαιρίνης. Η καταστολή της TSH μειώνει τα ποσοστά υποτροπής του όγκου, ιδιαίτερα στους νεαρούς ασθενείς με θηλώδη και θυλακιώδη καρκίνο του θυρεοειδούς. Για τους λόγους αυτούς χορηγείται μετεγχειρητικά στους ασθενείς η θυρεοειδική ορμόνη θυροξίνη (Τ4) σε δοσολογία 1 mg/ημέρα. Σε ασθενείς χαμηλού κινδύνου γίνεται προσπάθεια διατήρησης των επιπέδων TSH ακριβώς λίγο κάτω από τα κατώτερα φυσιολογικά όρια, δηλαδή μεταξύ 0,1 και 0,5 mU/ml. Σε ασθενείς υψηλού κινδύνου η δοσολογία προσαρμόζεται κατά τέτοιο τρόπο ώστε να διατηρηθεί το επίπεδο της TSH <0,1 mU/ml, γιατί με τον τρόπο αυτό αυξάνεται η επιβίωση ελεύθερης νόσου. Ο προβληματισμός όμως αφορά στο επίπεδο της καταστολής της TSH, το οποίο θα πρέπει να ισορροπήσει μεταξύ του κινδύνου της υποτροπής και των κινδύνων του υποκλινικού υπερθυρεοειδισμού, όπως επίταση στηθάγχης, κολπικής μαρμαρυγής και οστεοπόρωσης σε μεταεμμηνοπαυσιακές γυναίκες.
Μέτρηση θυρεοσφαιρίνης (Tg)
Η μέτρηση της περιφερικής θυρεοσφαιρίνης (Tg) είναι ιδιαίτερα χρήσιμη για την αξιολόγηση της μετεγχειρητικής πορείας των ασθενών, στο πλαίσιο της παρακολούθησης μετά από θυρεοειδεκτομή για την εκτομή διαφοροποιημένου καρκίνου. Έχει προγνωστική αξία για την πιθανότητα υποτροπής των καλά διαφοροποιημένων καρκινωμάτων του θυρεοειδούς (θηλώδη, θυλακιώδη καρκινώματα), είτε τοπικά είτε σαν μεταστατικές εναποθέσεις. Αν το άτομο όμως έχει υποβληθεί σε ολική θυρεοειδεκτομή και δεν υπάρχει υπολειμματικός αδενωματώδης θυρεοειδικός ιστός, τότε κανονικά δεν θα πρέπει να ανιχνεύεται Tg στην κυκλοφορία. Προοδευτική αύξηση των επιπέδων της Tg μετεγχειρητικά αποτελεί σοβαρή ένδειξη υποτροπής της νόσου.
Επισημαίνεται ότι η Tg είναι μια φυσιολογική ουσία, απαραίτητη για την θυρεοειδική λειτουργία και τα επίπεδά της δεν υποδηλώνουν απαραίτητα κακοήθεια, γι’ αυτό και ο χαρακτηρισμός της ως καρκινικός δείκτης κατά κάποιο τρόπο είναι υπερβολικός. Ωστόσο, ο προεγχειρητικός προσδιορισμός της Tg είναι χρήσιμος, αλλά χρειάζεται μεγάλη προσοχή και ευρύτητα γνώσεων για την ορθή αξιολόγηση του αποτελέσματος.
Σε κάθε περίπτωση ο προσδιορισμός της Tg και η χρήση της ως καρκινικός δείκτης αποκτά σημασία μόνο μετά από ολική θυρεοειδεκτομή ή μετά την κατάλυση των θυρεοειδικών υπολειμμάτων με ραδιενεργό ιώδιο.
Τα επίπεδα της Tg μπορεί να παραμείνουν αυξημένα για μερικούς μήνες ακόμη και μετά την πλήρη αφαίρεση η κατάλυση του θυρεοειδικού ιστού. Αυτό σημαίνει ότι η μέτρησή της δεν πρέπει να αξιολογείται νωρίτερα από 3 – 6 μήνες μετά την επέμβαση ή την θεραπεία με το ιώδιο.
Οι φυσιολογικές τιμές της Tg κυμαίνονται από 1 μέχρι 3 μg/L. Τα επίπεδα της Tg στους ασθενείς που έχουν υποβληθεί σε ολική θυρεοειδεκτομή για διαφοροποιημένο καρκίνωμα θα πρέπει να είναι <2ng/mL, όταν ο ασθενής λαμβάνει θυροξίνη (Τ4) και <5ng/mL όταν ο ασθενής είναι υποθυρεοειδικός. Σχεδόν το 20% των ασθενών που δεν εμφανίζουν νεοπλασματική νόσο κλινικά με επίπεδα Tg <2ng/ml κατά την διάρκεια της ορμονικής καταστολής, θα αναπτύξουν επίπεδα Tg >5 ng/ml μετά την χορήγηση ανασυνδυασμένης TSH ή μετά την διακοπή των θυρεοειδικών ορμονών. Το ένα τρίτο αυτών των ασθενών θα παρουσιάσει εμμένουσα νεοπλασματική νόσο με απεικονιστική τεκμηρίωση.
Περίπου το 95% των ασθενών με υπολειμματικό ή υποτροπιάζοντα καρκίνο του θυρεοειδούς που προέρχεται από θυλακιώδη κύτταρα θα έχει επίπεδα Tg >3ng/mL. Επίπεδα θυρεοσφαιρίνης >5ng/mlθεωρούνται πολύ ευαίσθητα για την ανάδειξη των ασθενών με υπολειμματική νεοπλασματική νόσο. Η κλινική σημασία των ελάχιστα ανιχνεύσιμων επιπέδων θυρεοσφαιρίνης είναι ασαφής, ειδικά όταν ανιχνεύονται μόνο μετά από διέγερση με TSH.
Κατά την αξιολόγηση του ασθενούς θα πρέπει να υπολογίζονται και τα επίπεδα της TSH προκειμένου να εκτιμηθεί, εάν διατελεί σε κατάσταση υποθυρεοειδισμού ή όχι. Η χορήγηση θυροξίνης που ακολουθεί την θυρεοειδεκτομή και την θεραπευτική χορήγηση ραδιενεργού ιωδίου έχει ως αποτέλεσμα την δραστική μείωση της TSH (καταστολή). Το γεγονός αυτό μειώνει την αξιοπιστία της Tg ως καρκινικός δείκτης. Γι’ αυτό, μη ανιχνεύσιμη Tg υπό αγωγή με θυροξίνη δεν αποκλείει υποτροπή ή μετάσταση. Μάλιστα έχει αναφερθεί ότι γύρω στο 1/3 των ασθενών με λεμφαδενικές μεταστάσεις και το 1/10 αυτών με εξωθυρεοειδικές μεταστάσεις δεν εμφανίζουν ανιχνεύσιμες τιμές Tg υπό αγωγή με θυροξίνη. Μετά την διακοπή της θυροξίνης βέβαια οι τιμές της TSH συνήθως αυξάνονται. Αν η Tg είναι ανιχνεύσιμη με κατεσταλμένη TSH, η υποτροπή θεωρείται πολύ πιθανή καθώς αυτή θα αυξηθεί περαιτέρω όταν αυξηθεί η TSH.
Η αύξηση της TSH δεν συμβαίνει μόνο μετά την διακοπή της θυροξίνης αλλά και μετά την χορήγηση ανθρώπινης ανασυνδυασμένης θυρεοειδοτρόπου ορμόνης (TSH), η οποία αντικαθιστά τελευταία στην κλινική πράξη την διακοπή της θυροξίνης, ως διαγνωστικό εργαλείο στην παρακολούθηση των διαφοροποιημένων θυρεοειδικών καρκίνων.
Μη ανιχνεύσιμη Tg μετά από αύξηση της TSH είναι σχεδόν αποδεικτική απουσίας τοπικών υποτροπών και απομακρυσμένων μεταστάσεων και ισχυρός δείκτης αποτελεσματικής θεραπείας.
Ο υπολογισμός της Tg επηρεάζεται από την παρουσία αυτοαντισωμάτων, τα οποία δίδουν ψευδώς μειωμένες τιμές. Το 25% των ασθενών με διαφοροποιημένο καρκίνο θυρεοειδούς έχουν αντιθυρεοσφαιρινικά αντισώματα, και ως εκ τούτου η παρακολούθηση με μέτρηση θυρεοσφαιρίνης δεν θεωρείται αξιόπιστη. Στα άτομα αυτά η μέτρηση θυρεοσφαιρίνης δεν θεωρείται αξιόπιστη. Σ’ αυτή την ομάδα ασθενών, η επαναλαμβανόμενη μέτρηση στο αίμα των αντισωμάτων αυτών μπορεί να χρησιμοποιηθεί ως δείκτης, βεβαίως χαμηλής ακρίβειας, για την ανίχνευση υποτροπής. Τα επίπεδα της θυρεοσφαιρίνης και των αντιθυρεοσφαιρινικών αντισωμάτων θα πρέπει να μετρούνται αρχικά ανά διαστήματα έξι (6) μηνών και στην συνέχεια ετησίως, εφόσον ο ασθενής είναι κλινικά ελεύθερος νόσου. Τονίζεται ότι σε άτομα με διαφοροποιημένο καρκίνο θυρεοειδή μετά ολική θυρεοειδεκτομή ή θεραπεία με ραδιενεργό ιώδιο, που έχουν αυξημένα αντιθυρεοειδικά αντισώματα και η Tg είναι <1 ng/mL ενώ βρίσκονται σε θεραπεία με θυροξίνη, πολλοί ερευνητές δεν συστήνουν τον προσδιορισμό της Tg μετά διακοπή της θεραπείας με θυροξίνη ή χορήγηση ανασυνδυασμένης TSH.
Θεραπεία με ραδιενεργό ιώδιο
Το ραδιενεργό ιώδιο προσλαμβάνεται ικανοποιητικά από τους διαφοροποιημένους καρκίνους του θυρεοειδούς, γιατί τα καρκινικά κύτταρα διατηρούν την ικανότητά τους να προσλαμβάνουν το ιώδιο. Η μετεγχειρητική θεραπεία με ραδιενεργό ιώδιο μειώνει τις υποτροπές και βελτιώνει την επιβίωση, ακόμη και στους χαμηλού κινδύνου ασθενείς. Αν και το σπινθηρογράφημα με ραδιενεργό ιώδιο είναι πιο ευαίσθητο από την ακτινογραφία θώρακος ή την CT για την ανίχνευση μεταστάσεων, είναι λιγότερο ευαίσθητη από τις μετρήσεις της Tg για την ανεύρεση μεταστατικής νόσου στους διαφοροποιημένους καρκίνους του θυρεοειδούς. Οι όγκοι από τα κύτταρα Hurthle μόνο σε ποσοστό 7,5% προσλαμβάνει το ραδιενεργό ιώδιο. Η απεικόνιση και η θεραπεία με ραδιενεργό ιώδιο διευκολύνονται με την αφαίρεση όλου του θυρεοειδικού ιστού, ο οποίος ανταγωνίζεται την πρόσληψη ιωδίου. Με βάση τις επικαιροποιημένες τρέχουσες οδηγίες για την μετεγχειρητική παρακολούθηση των ασθενών με καλά διαφοροποιημένους καρκίνους του θυρεοειδούς, εκτός από τους ασθενείς χαμηλού κινδύνου, συνιστάται ραδιοκατάλυση των θυρεοειδικών υπολειμμάτων και φαρμακευτική καταστολή της TSH.
Γενικά, η θεραπεία με θυροξίνη (T4) θα πρέπει να διακόπτεται για περίπου 6 εβδομάδες πριν την θεραπεία με ραδιενεργό ιώδιο-131. Οι ασθενείς αυτή την περίοδο θα πρέπει να λαμβάνουν T3 (Thyrohormone) για να αποφευχθεί ο υποθυρεοειδισμός. Η T3 έχει μικρότερο χρόνο ημιζωής από την T4 (μία ημέρα έναντι μιας εβδομάδας) και πρέπει να διακόπτεται για 2 εβδομάδες για να ανεβούν τα επίπεδα της TSH πριν την θεραπεία. Επίσης, σε αυτή την περίοδο των 2 εβδομάδων συνιστάται δίαιτα με τροφές χαμηλής περιεκτικότητας σε ιώδιο. Πριν το σπινθηρογράφημα και την θεραπεία με ραδιενεργό ιώδιο, αλλά και πριν τον απεικονιστικό έλεγχο μετά την θεραπεία, πρέπει να προσδιορίζονται τα επίπεδα TSH, θυρεοσφαιρίνης και στις γυναίκες αναπαραγωγικής ηλικίας πραγματοποιείται δοκιμασία κυήσεως.
Η μετεγχειρητική χορήγηση ραδιενεργού ιωδίου συνιστάται για πρωτοπαθή όγκο μεγέθους >1,5cm, πολυεστιακή νόσο ή παρουσία λεμφαδενικών μεταστάσεων. Το διηθητικό FTC, καθώς και το καρκίνωμα από κύτταρα Hurthle, χρήζουν επίσης συμπληρωματικής θεραπείας με ραδιενεργό ιώδιο. Το διαφοροποιημένο μεταστατικό καρκίνωμα του θυρεοειδούς μπορεί να ανιχνευθεί και να θεραπευθεί πλήρως με ραδιενεργό ιώδιο-131 σε ποσοστό 75% των ασθενών. Πολλές μελέτες δείχνουν ότι το ραδιενεργό ιώδιο θεραπεύει επιτυχώς περισσότερες από το 70% των μικρομεταστάσεων του πνεύμονα, οι οποίες ανιχνεύονται με το σπινθηρογράφημα με ιώδιο, ενώ η ακτινογραφία θώρακος δείχνει φυσιολογικά ευρήματα.
Το καθιερωμένο θεραπευτικό πρωτόκολλο περιλαμβάνει την χορήγηση μιας δόσης αναφοράς της τάξεως των 2mCi ραδιενεργού ιωδίου-131 και κατόπιν την μέτρηση της πρόσληψης, 24 ώρες αργότερα. Μετά από ολική θυρεοειδεκτομή, αυτή η τιμή θα πρέπει να είναι <1%. Μια «θερμή» εντόπιση στον τράχηλο μετά την αρχική απεικόνιση αντιπροσωπεύει υπόλειμμα φυσιολογικού ιστού στην θέση του θυρεοειδούς. Εάν υπάρχει σημαντική πρόσληψη, τότε θα πρέπει να χορηγηθεί στους ασθενείς θεραπευτική δόση ιωδίου-131 (χαμηλού κινδύνου ασθενείς: 30 έως 100mCi, υψηλού κινδύνου ασθενείς: 100 έως 200mCi). Εάν οι ασθενείς έχουν αυξημένα επίπεδα Tg, αλλά αρνητικό σπινθηρογράφημα με ιώδιο-131, ορισμένοι ερευνητές συνιστούν θεραπεία με 100 mCi ραδιενεργού ιωδίου-131 και επανάληψη του σπινθηρογραφήματος 1 με 2 εβδομάδες αργότερα. Περίπου το ένα τρίτο αυτών των ασθενών εμφανίζουν πρόσληψη στην απεικόνιση μετά την θεραπεία και τα επίπεδα της Tg συνήθως μειώνονται, αποδεικνύοντας έτσι θεραπευτικό όφελος. Άλλοι συνιστούν την παράλειψη της δόσης για σπινθηρογραφική μελέτη εξ ολοκλήρου, για να ελαττώσουν την «καθυστέρηση» των θυρεοειδικών κυττάρων και την επακόλουθη απαίτηση για υψηλότερες δόσεις. Οι ασθενείς με προηγούμενα θετικά σπινθηρογραφήματα και αυτοί με επίπεδα θυρεοσφαιρίνης ορού >2ng/mL συνήθως χρειάζονται μια ακόμη θεραπεία με ιώδιο-131 μετά από 6 με 12 μήνες, ωσότου επιτευχθούν μία ή δύο αρνητικές απεικονίσεις. Η απεικόνιση επανελέγχου μπορεί να διενεργηθεί μετά από ορμονική στέρηση ή μετά από χορήγηση ανασυνδυασμένης TSH. Η μέγιστη δόση του ραδιενεργού ιωδίου που μπορεί να χορηγηθεί την φορά χωρίς να διενεργηθεί δοσομέτρηση κυμαίνεται γύρω στα 200mCi με την συνολική δόση να είναι 1000 έως 1500mCi. Άνω των 500mCi μπορούν να χορηγηθούν με την κατάλληλη δοσομέτρηση πριν από την θεραπεία.
Άλλες απεικονιστικές μέθοδοι
Εφόσον τα σπινθηρογραφήματα με ραδιενεργό ιώδιο-131 είναι αρνητικά, αλλά τα επίπεδα της Tg παραμένουν υψηλά, μπορούν να πραγματοποιηθούν και άλλες απεικονιστικές εξετάσεις όπως είναι το υπερηχογράφημα τραχήλου, η CT, η MRI και το FDG-PET-scan.
Ακτινοθεραπεία εξωτερικής δέσμης και χημειοθεραπεία
Η ακτινοβολία και η χημειοθεραπεία έχουν περιορισμένο ρόλο στην μετεγχειρητική αντιμετώπιση ασθενών με καρκίνο του θυρεοειδούς. Η χορήγηση ακτινοβολίας χρησιμοποιείται ως παρηγορική θεραπεία σε τοπικά εκτεταμένους ή ανεγχείρητους όγκους, σε περιπτώσεις θετικών ορίων εκτομής ή επί υποτροπής της νόσου μετά από επανεπέμβαση. Η ακτινοθεραπεία εξωτερικής δέσμης εφαρμόζεται περιστασιακά για να ελεγχθεί μια ανθεκτική, τοπικά διηθητική και να θεραπεύσει οστικές μεταστάσεις προκειμένου να μειωθεί ο κίνδυνος των καταγμάτων. Επίσης έχει εφαρμογή για τον έλεγχο και την ανακούφιση του πόνου από τις οστικές μεταστάσεις, όταν απουσιάζει η πρόσληψη ραδιενεργού ιωδίου-131.
Η χορήγηση χημειοθεραπείας έχει αποδώσει ελάχιστα οφέλη στην αντιμετώπιση των καλώς διαφοροποιημένων καρκίνων του θυρεοειδούς. Η χημειοθεραπεία με ένα ή συνδυασμό πολλών φαρμάκων έχει χρησιμοποιηθεί με μικρή επιτυχία σε διάχυτο καρκίνο του θυρεοειδούς. Η αδριαμυκίνη και το Τaxol είναι οι συχνότερα χρησιμοποιούμενοι χημειοθεραπευτικοί παράγοντες.
Yποτροπή
Οι απόψεις αναφορικά με την αντιμετώπιση του υποτροπιάζοντος καλά διαφοροποιημένου θυρεοειδικού καρκίνου, που αναδεικνύεται με το υπερηχογράφημα, είναι αντικρουόμενες. Επικρατεί η άποψη ότι θα πρέπει να επιχειρείται η επανεπέμβαση στους ασθενείς αυτούς και να αφαιρούνται οι ύποπτες βλάβες. Επειδή όμως η επανεπέμβαση σε έναν ήδη χειρουργημένο τράχηλο αυξάνει την πιθανότητα επιπλοκών, η έκταση της επέμβασης θα πρέπει να είναι περιορισμένη και η προεγχειρητική υπερηχογραφία μπορεί να βοηθήσει για το σκοπό αυτό. Προτείνεται προεγχειρητικά η εντοπιστική τοποθέτηση βελόνης στους λεμφαδένες του κεντρικού τμήματος του τραχήλου που φέρουν την υποτροπή. Μερικοί συγγραφείς προτείνουν την ενδοϊστική έγχυση αλκοόλης ή την κατάλυση με ραδιοκύματα για την θεραπεία αυτών των υποτροπών.
Καρκίνωμα από κύτταρα Hurthle
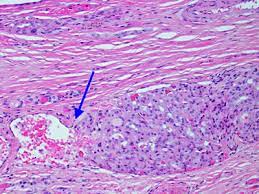 Ο καρκίνος από οξεόφιλα κύτταρα Hurthle αντιστοιχεί στο 3% του συνόλου των καρκίνων του θυρεοειδούς. Σύμφωνα με την ταξινόμηση της παγκόσμιας οργάνωσης υγείας (WHO), τα καρκινώματα από κύτταρα Hurthle θεωρούνται υποκατηγορία και κλινική παραλλαγή του θυλακιώδους καρκίνου και μοιάζει με αυτό τόσο στην κλινική εικόνα όσο και στην μικροσκοπική εξέταση. Αν και είναι σπάνιος, τα κύτταρα Huerthle εμφανίζονται συχνά σε FNAΒ και ιδιαίτερα σε αρρώστους με Hashimoto ή κολλοειδείς όζους με επακόλουθο να δημιουργείται διαγνωστικό πρόβλημα. Οι όγκοι αυτοί περιέχουν στρώσεις ηωσινόφιλων κυττάρων γεμάτα με μιτοχόνδρια, τα οποία προέρχονται από τα οξεόφιλα κύτταρα του θυρεοειδούς. Αυτά τα κύτταρα παράγονται από τα θυλακιώδη κύτταρα και έχουν άφθονο κοκκώδη οξεόφιλο κυτταρόπλασμα. Το καρκίνωμα από κύτταρα Hurthle έχει χειρότερη κλινική πρόγνωση από το θυλακιώδες καρκίνο και υψηλότερο ποσοστό υποτροπής, ιδιαίτερα στους περιφερειακούς λεμφαδένες.
Ο καρκίνος από οξεόφιλα κύτταρα Hurthle αντιστοιχεί στο 3% του συνόλου των καρκίνων του θυρεοειδούς. Σύμφωνα με την ταξινόμηση της παγκόσμιας οργάνωσης υγείας (WHO), τα καρκινώματα από κύτταρα Hurthle θεωρούνται υποκατηγορία και κλινική παραλλαγή του θυλακιώδους καρκίνου και μοιάζει με αυτό τόσο στην κλινική εικόνα όσο και στην μικροσκοπική εξέταση. Αν και είναι σπάνιος, τα κύτταρα Huerthle εμφανίζονται συχνά σε FNAΒ και ιδιαίτερα σε αρρώστους με Hashimoto ή κολλοειδείς όζους με επακόλουθο να δημιουργείται διαγνωστικό πρόβλημα. Οι όγκοι αυτοί περιέχουν στρώσεις ηωσινόφιλων κυττάρων γεμάτα με μιτοχόνδρια, τα οποία προέρχονται από τα οξεόφιλα κύτταρα του θυρεοειδούς. Αυτά τα κύτταρα παράγονται από τα θυλακιώδη κύτταρα και έχουν άφθονο κοκκώδη οξεόφιλο κυτταρόπλασμα. Το καρκίνωμα από κύτταρα Hurthle έχει χειρότερη κλινική πρόγνωση από το θυλακιώδες καρκίνο και υψηλότερο ποσοστό υποτροπής, ιδιαίτερα στους περιφερειακούς λεμφαδένες.
Όπως και στην περίπτωση των θυλακιωδών καρκινωμάτων, η μεγαλύτερη επίπτωση παρατηρείται μεταξύ 5ης και 6ης δεκαετίας της ζωής. Η αναλογία γυναικών : ανδρών κυμαίνεται από 2:1 έως 10:1. Οι άνδρες με νεόπλασμα από κύτταρα Hurthle διατρέχουν μεγαλύτερο κίνδυνο κακοηθείας. Το ιστορικό ακτινοβόλησης της περιοχής του τραχήλου σχετίζεται με αυξημένο κίνδυνο ανάπτυξης αυτών των νεοπλασμάτων και μάλιστα με αμφοτερόπλευρες και πολυεστιακές βλάβες, καθώς και με αυξημένη συχνότητα κακοηθειών άλλου ιστολογικού τύπου στον αντίπλευρο λοβό του θυρεοειδούς. Η 10ετής επιβίωση της νόσου ανέρχεται στο 70%, ενώ η 20ετής θνητότητα οφειλόμενη αποκλειστικά στην νόσο για τους όγκους αυτούς ανέρχεται στο 27%. Η πρόγνωση εξαρτάται από την έκταση της νόσου κατά την αρχική διάγνωση και την ριζικότητα της επέμβασης. Οι όγκοι από κύτταρα Hurthle παράγουν θυρεοσφαιρίνη και ταξινομούνται σύμφωνα με το σύστημα ΤΝΜ.
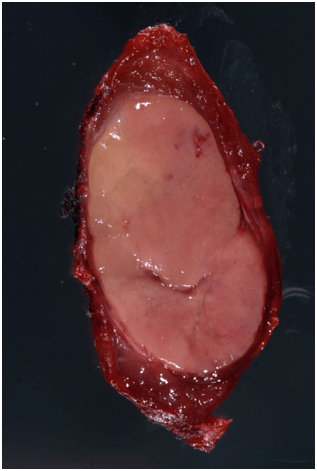 Οι περισσότεροι ασθενείς με καρκίνο από κύτταρα Hurthle προσέρχονται με μονήρη θυρεοειδικό όζο. Η FNAB μπορεί να διαγνώσει με αξιοπιστία τα νεοπλάσματα αυτά, αλλά, όπως και με τα θυλακιώδη νεοπλάσματα, δεν μπορεί να διακρίνει τα καλοήθη αδενώματα από την κακοήθεια, η οποία είναι παρούσα στο 35% των περιπτώσεων. Η κακοήθεια καθορίζεται από την διήθηση της κάψας ή/και των αγγείων. Διαφέρουν από τα θυλακιώδη καρκινώματα στο ότι είναι συχνότερα πολυεστιακά και αμφίπλευρα (περίπου 30%) και συνήθως δεν προσλαμβάνουν το ραδιενεργό ιώδιο (περίπου 7,5%). Σε ασθενείς με κακοήθεις βλάβες, στο 75% η νόσος περιορίζεται στον αδένα, στο 15% υπάρχει λεμφαδενική διασπορά της νόσου και στο 15% ανιχνεύονται μακρινές μεταστάσεις, συνήθως στα οστά ή στους πνεύμονες.
Οι περισσότεροι ασθενείς με καρκίνο από κύτταρα Hurthle προσέρχονται με μονήρη θυρεοειδικό όζο. Η FNAB μπορεί να διαγνώσει με αξιοπιστία τα νεοπλάσματα αυτά, αλλά, όπως και με τα θυλακιώδη νεοπλάσματα, δεν μπορεί να διακρίνει τα καλοήθη αδενώματα από την κακοήθεια, η οποία είναι παρούσα στο 35% των περιπτώσεων. Η κακοήθεια καθορίζεται από την διήθηση της κάψας ή/και των αγγείων. Διαφέρουν από τα θυλακιώδη καρκινώματα στο ότι είναι συχνότερα πολυεστιακά και αμφίπλευρα (περίπου 30%) και συνήθως δεν προσλαμβάνουν το ραδιενεργό ιώδιο (περίπου 7,5%). Σε ασθενείς με κακοήθεις βλάβες, στο 75% η νόσος περιορίζεται στον αδένα, στο 15% υπάρχει λεμφαδενική διασπορά της νόσου και στο 15% ανιχνεύονται μακρινές μεταστάσεις, συνήθως στα οστά ή στους πνεύμονες.
Η αντιμετώπιση είναι παρεμφερής με εκείνη των θυλακιωδών νεοπλασμάτων, με την λοβεκτομή + ισθμεκτομή να θεωρούνται επαρκείς για μονόπλευρο αδένωμα από κύτταρα Hurthle. Η ταχεία βιοψία δεν είναι αξιόπιστη σε νεοπλάσματα από κύτταρα Hurthle, όπως και στα θυλακιώδη νεοπλάσματα και θα πρέπει να αξιολογείται με προσοχή στην λήψη θεραπευτικών αποφάσεων. Σε ασθενείς με εμφανή κακοήθεια ή αντίπλευρη λεμφαδενική διήθηση ή σε ασθενείς με ιστορικό ακτινοβόλησης της κεφαλής και του τραχήλου κατά την παιδική ηλικία, πραγματοποιείται εξαρχής ολική θυρεοειδεκτομή. Αυτοί οι ασθενείς θα πρέπει επίσης να υποβάλλονται σε κεντρικό λεμφαδενικό καθαρισμό του τραχήλου, όπως γίνεται στους ασθενείς με μυελοειδές καρκίνωμα (MTC) και τροποποιημένη λεμφαδενεκτομή όταν υπάρχουν ψηλαφητοί λεμφαδένες στην πλάγια τραχηλική χώρα ή φαίνονται παθολογικοί στο υπερηχογράφημα. Αν και το ραδιενεργό ιώδιο-131 δεν θεωρείται και τόσο αποτελεσματικό σ’ αυτό τον τύπο νεοπλάσματος, ωστόσο μπορεί να χρησιμοποιηθεί περιστασιακά για την κατάλυση υπολειμματικού νεοπλασματικού ιστού, διότι δεν υπάρχει άλλη αποτελεσματική θεραπεία.
Μυελοειδές καρκίνωμα θυρεοειδούς
 Το μυελοειδές καρκίνωμα του θυρεοειδούς (Medullary Thyroid Cancer / MTC) αποτελεί το 6% του συνόλου των καρκίνων του θυρεοειδούς και την αιτία για το 15% των θανάτων που οφείλονται σε καρκίνο του αδένα. Οι όγκοι αυτοί προέρχονται από τα C ή παραθυλακιώδη κύτταρα των τελικών βραγχιακών σωματίων. Αυτά τα κύτταρα βρίσκονται συγκεντρωμένα στο πάνω και πλάγιο τμήμα του θυρεοειδούς στο ύψος του κρικοειδούς χόνδρου. Τα κύτταρα C εκκρίνουν καλσιτονίνη, ένα πολυπεπτίδιο με 32 αμινοξέα που ρυθμίζει τα επίπεδα ασβεστίου στο αίμα. Σε ορισμένα ζώα, ιδιαίτερα σε αυτά που γεννούν αυγά με κέλυφος, η καλσιτονίνη ρυθμίζει τον μεταβολισμό του ασβεστίου, αλλά στους ανθρώπους ο ρόλος της είναι υποδεέστερος. Κατά ενδιαφέροντα τρόπο, η περίσσεια της καλσιτονίνης δεν συσχετίζεται με υπερβάλλουσα κλινική δραστηριότητα, δηλαδή την υπασβεστιαιμία. Τα μυελοειδή καρκινικά κύτταρα υπερεκκρίνουν και άλλες ουσίες, όπως προσταγλανδίνες, σεροτονίνη, σωματοστατίνη κλπ. και αυτό εξηγεί την ιδιαίτερη συμπτωματολογία, όπως επί παραδείγματι είναι η επίμονη διάρροια. Οι περισσότεροι ασθενείς εκδηλώνουν την νόσο στην ηλικία μεταξύ των 50 και 60 ετών, ενώ σε ασθενείς με οικογενή νόσο εμφανίζεται σε πιο νεαρή ηλικία. Η αναλογία μεταξύ ανδρών : γυναικών είναι 1,5 : 1.
Το μυελοειδές καρκίνωμα του θυρεοειδούς (Medullary Thyroid Cancer / MTC) αποτελεί το 6% του συνόλου των καρκίνων του θυρεοειδούς και την αιτία για το 15% των θανάτων που οφείλονται σε καρκίνο του αδένα. Οι όγκοι αυτοί προέρχονται από τα C ή παραθυλακιώδη κύτταρα των τελικών βραγχιακών σωματίων. Αυτά τα κύτταρα βρίσκονται συγκεντρωμένα στο πάνω και πλάγιο τμήμα του θυρεοειδούς στο ύψος του κρικοειδούς χόνδρου. Τα κύτταρα C εκκρίνουν καλσιτονίνη, ένα πολυπεπτίδιο με 32 αμινοξέα που ρυθμίζει τα επίπεδα ασβεστίου στο αίμα. Σε ορισμένα ζώα, ιδιαίτερα σε αυτά που γεννούν αυγά με κέλυφος, η καλσιτονίνη ρυθμίζει τον μεταβολισμό του ασβεστίου, αλλά στους ανθρώπους ο ρόλος της είναι υποδεέστερος. Κατά ενδιαφέροντα τρόπο, η περίσσεια της καλσιτονίνης δεν συσχετίζεται με υπερβάλλουσα κλινική δραστηριότητα, δηλαδή την υπασβεστιαιμία. Τα μυελοειδή καρκινικά κύτταρα υπερεκκρίνουν και άλλες ουσίες, όπως προσταγλανδίνες, σεροτονίνη, σωματοστατίνη κλπ. και αυτό εξηγεί την ιδιαίτερη συμπτωματολογία, όπως επί παραδείγματι είναι η επίμονη διάρροια. Οι περισσότεροι ασθενείς εκδηλώνουν την νόσο στην ηλικία μεταξύ των 50 και 60 ετών, ενώ σε ασθενείς με οικογενή νόσο εμφανίζεται σε πιο νεαρή ηλικία. Η αναλογία μεταξύ ανδρών : γυναικών είναι 1,5 : 1.
Πρόκειται για επικρατούσα αυτόσωμο κληρονομική θυρεοειδοπάθεια και σχετίζεται με μια ομάδα ειδικών πολλαπλασιασμών στο χρωμόσωμα 10q11.2 (RET πρωτοογκογονίδιο). Ποσοστό 75% εμφανίζεται με την σποραδική μορφή και το υπόλοιπο 25% ως οικογενής μορφή, είτε αμιγώς είτε με συμμετοχή στα πολλαπλά ενδοκρινικά σύνδρομα τύπου MEN2και ΜΕΝ3.
Το μυελοειδές καρκίνωμα μπορεί να συνυπάρχει με φαιοχρωμοκύττωμα (συχνά αμφοτερόπλευρο), ομαλό λειχήνα, αμυλοείδωση και υπερπαραθυρεοειδισμό και τότε συγκροτεί το σύνδρομο ΜΕΝ 2Α. Επίσης μπορεί να συνυπάρχει με φαιοχρωμοκύττωμα (συνήθως αμφοτερόπλευρο), σωματότυπο συνδρόμου Marfan, πολλαπλά νευρώματα και γαγγλιονευρωμάτωση, οπότε τότε αποτελεί το σύνδρομο ΜΕΝ 2Β. Η νόσος Hirschsprung παρατηρείται συχνότερα σε ασθενείς με οικογενές μυελοειδές καρκίνωμα.
Στη σποραδική μορφή της νόσου υπάρχει μία μονήρης ετερόπλευρη βλάβη στο 85% των περιπτώσεων, ενώ, αντίθετα, στο 90% των περιπτώσεων της οικογενούς μορφής της νόσου, αυτή είναι πολυεστιακή και αμφοτερόπλευρη.
To MTC σχετίζεται με μετάλλαξη του πρωτοογκογονιδίου RET. Οι κληρονομικές μορφές του MTCαφορούν το σύνδρομο, το σύνδρομο MEN3 και το οικογενές MTC. Σε όλες αυτές τις μορφές ανιχνεύονται σημειακές μεταλλάξεις του γονιδίου RET. Η διάγνωση του οικογενούς MTCτεκμηριώνεται όταν τρία ή περισσότερα άτομα της ίδιας οικογένειας εκδηλώσουν την νόσο, ενώ απουσιάζει κάθε άλλη ενδοκρινοπάθεια. Στο 10% των σποραδικών περιπτώσεων της νόσου, ανιχνεύεται επίσης μία de novo μετάλλαξη του RET και για τον λόγο αυτό, κάθε νέος ασθενής με μυελοειδή καρκίνο θα πρέπει να υποβάλλεται σε γενετικό έλεγχο για το ογκογονίδιο RET, να ελέγχεται για φαιοχρωμοκύττωμα και για υπερπαραθυρεοειδισμό. Ο γενετικός έλεγχος και η χειρουργική θεραπεία θα πρέπει να ξεκινούν πριν από την ηλικία των 5 ετών στην περίπτωση συνδρόμου MEN2 και αμέσως μετά την γέννηση στην περίπτωση συνδρόμου MEN3.
Παθολογοανατομία
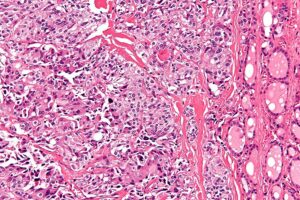 Οι ΜΤC εντοπίζονται τυπικά μονόπλευρα (80%) στους ασθενείς με σποραδική νόσο και πολυεστιακά στις οικογενείς περιπτώσεις, με τους αμφίπλευρους όγκους να ανιχνεύονται σε ποσοστό >90% των ασθενών. Στα οικογενή περιστατικά αναδεικνύεται επίσης υπερπλασία των κυττάρων C, η οποία θεωρείται προκαρκινική κατάσταση. Μικροσκοπικά, οι όγκοι αποτελούνται από στοιβάδες νεοπλασματικών κυττάρων, τα οποία διαχωρίζονται με κολλαγόνο και στο υπόστρωμα περιέχουν αμυλοειδές. Διακρίνεται εμφανής ετερογένεια των κυττάρων τα οποία είναι πολυγωνικά ήατρακτόμορφα. Η παρουσία τουσυμβάλλει στην διάγνωση, αλλά η ανοσοϊστοχημεία της καλσιτονίνης χρησιμοποιείται συχνά ως διαγνωστικός καρκινικός δείκτης. Αυτοί οι όγκοι επίσης δίνουν θετική χρώση για τον νεοπλασματικό δείκτη CEA και το σχετιζόμενο με το γονίδιο της καλσιτονίνης πεπτίδιο (CGRP).
Οι ΜΤC εντοπίζονται τυπικά μονόπλευρα (80%) στους ασθενείς με σποραδική νόσο και πολυεστιακά στις οικογενείς περιπτώσεις, με τους αμφίπλευρους όγκους να ανιχνεύονται σε ποσοστό >90% των ασθενών. Στα οικογενή περιστατικά αναδεικνύεται επίσης υπερπλασία των κυττάρων C, η οποία θεωρείται προκαρκινική κατάσταση. Μικροσκοπικά, οι όγκοι αποτελούνται από στοιβάδες νεοπλασματικών κυττάρων, τα οποία διαχωρίζονται με κολλαγόνο και στο υπόστρωμα περιέχουν αμυλοειδές. Διακρίνεται εμφανής ετερογένεια των κυττάρων τα οποία είναι πολυγωνικά ήατρακτόμορφα. Η παρουσία τουσυμβάλλει στην διάγνωση, αλλά η ανοσοϊστοχημεία της καλσιτονίνης χρησιμοποιείται συχνά ως διαγνωστικός καρκινικός δείκτης. Αυτοί οι όγκοι επίσης δίνουν θετική χρώση για τον νεοπλασματικό δείκτη CEA και το σχετιζόμενο με το γονίδιο της καλσιτονίνης πεπτίδιο (CGRP).
Τα μυελοειδή καρκινώματα μεθίστανται με σειρά προτεραιότητας στους επιχώριους λεμφαδένες, στους πνεύμονες, στο ήπαρ και στα οστά.
Εργαστηριακές εξετάσεις – Διάγνωση
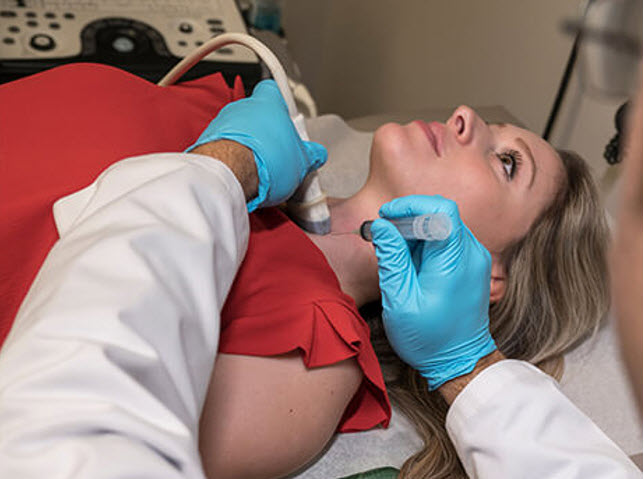 Επί απουσίας σχετικού ιστορικού οικογενούς μυελοειδούς καρκινώματος, δεν υπάρχουν στοιχεία που να διαφοροποιούν το MTC από τα άλλα νεοπλάσματα του θυρεοειδούς. Η διάγνωση του MTC βασίζεται στο ιστορικό, στην φυσική εξέταση, στα υψηλά επίπεδα καλσιτονίνης ορού και CEA και στην κυτταρολογική εξέταση της βλάβης του θυρεοειδούς με FNAΒ. Η διάγνωση τεκμηριώνεται από την χαρακτηριστική κυτταρομορφολογία και τον ανοσοϊστοχημικό έλεγχο για καλσιτονίνη.
Επί απουσίας σχετικού ιστορικού οικογενούς μυελοειδούς καρκινώματος, δεν υπάρχουν στοιχεία που να διαφοροποιούν το MTC από τα άλλα νεοπλάσματα του θυρεοειδούς. Η διάγνωση του MTC βασίζεται στο ιστορικό, στην φυσική εξέταση, στα υψηλά επίπεδα καλσιτονίνης ορού και CEA και στην κυτταρολογική εξέταση της βλάβης του θυρεοειδούς με FNAΒ. Η διάγνωση τεκμηριώνεται από την χαρακτηριστική κυτταρομορφολογία και τον ανοσοϊστοχημικό έλεγχο για καλσιτονίνη.
Η διάγνωση στα μυελοειδή καρκινώματα διευκολύνεται από την μέτρηση της καλσιτονίνης στον ορό. Αυτή μπορεί να είναι πολύ αυξημένη, αλλά στην πρώιμη φάση μπορεί η βασική τιμή της να είναι σε φυσιολογικά επίπεδα και να παρατηρείται αυξημένη αντίδραση μόνο μετά από ένεση ασβεστίου, πενταγαστρίνης ή γλυκαγόνης. Αυτός ο έλεγχος πρέπει να γίνεται σε όλα τα μέλη των οικογενειών με ιστορικό οικογενούς μυελοειδούς καρκινώματος. Επισημαίνεται ότι υπερέκκριση καλσιτονίνης παρατηρείται σπάνια και σε άλλα νεοπλάσματα στο πλαίσιο παρανεοπλασματικού συνδρόμου, κυρίως στα βρογχογενή καρκινώματα και στο σύνδρομο Zollinger – Ellison.
Οι καρκινικοί δείκτες και η καλσιτονίνη ενισχύουν την διάγνωση και οι τιμές τους σχετίζονται με την καρκινική μάζα, τις λεμφαδενικές και τις απομακρυσμένες μεταστάσεις. Επίπεδα καλσιτονίνης >1000 pg/ml, μετά από ολική θυρεοειδεκτομή και χωρίς εμφανή στοιχεία υποτροπής της νόσου στον τράχηλο, είναι ενδεικτικά απομακρυσμένων μεταστάσεων (συνήθως μικρομεταστάσεις στο ήπαρ). Ορισμένοι χειρουργοί συνιστούν διαγνωστική λαπαροσκόπηση πριν από την αρχική επέμβαση, με σκοπό τον έλεγχο του ήπατος, δεδομένου ότι αποτελεί την πιο συχνή θέση εναπόθεσης μεταστατικών εστιών. To MTC μεθίσταται επίσης στους πνεύμονες και στα οστά. Τα υψηλά επίπεδα CEAσχετίζονται με δυσμενή πρόγνωση. Ασθενείς με ερυθρότητα προσώπου και διάρροια έχουν επίσης φτωχή πρόγνωση, όπως και οι ασθενείς με σύνδρομο MEN3.
Είναι σημαντικό να διερευνάται με επιμέλεια το ιατρικό ιστορικό του ασθενούς διότι το 25% των ασθενών με MTC έχουν τον οικογενή τύπο της νόσου. Επειδή δεν είναι εφικτή η διάκριση μεταξύ της σποραδικής και της οικογενούς μορφής της νόσου κατά την αρχική παρουσίαση, όλοι οι νεοδιαγνωσμένοι ασθενείς με MTC θα πρέπει να ελέγχονται για μεταλλάξεις του γονιδίου RET, για φαιοχρωμοκύττωμα (24ωρα επίπεδα VΜΑ ούρων, κατεχολαμίνες και μετανεφρίνη) και υπερπαραθυρεοειδισμό (παραθορμόνη, ασβέστιο ορού). Εάν συνυπάρχει φαιοχρωμοκύττωμα στο πλαίσιο του συνδρόμου ΜΕΝ, ενδέχεται να εκδηλωθεί επεισόδιο υπερτασικής κρίσης ή ακόμα και αιφνίδιος θάνατος κατά την θυρεοειδεκτομή.
Στο σποραδικό ΜCT ο όγκος είναι μονήρης, ετερόπλευρος και δεν σχετίζεται με το οικογενειακό ιστορικό. Συνήθως έχει βραδεία εξέλιξη και μπορεί να είναι ανενεργής για πολύ καιρό. Εκδηλώνεται κλινικά γύρω στην ηλικία των 30 ετών. Ο ασθενής με σποραδικό μυελοειδές καρκίνωμα διαγιγνώσκεται με έναν από τους δύο τρόπους: α) με ψηλαφητή μάζα στον τράχηλο όπου η FNAΒ θέτει την διάγνωση και β) με τις υψηλές τιμές καλσιτονίνης. Η παρουσία θυρεοειδικής μάζας και αυξημένων επιπέδων καλσιτονίνης είναι διαγνωστική για ΜCT, ενώ οι υψηλές τιμές καλσιτονίνης χωρίς όμως θυρεοειδική μάζα επιβάλλει περαιτέρω έλεγχο με επανάληψη της μέτρησης της καλσιτονίνης και μάλιστα με την δοκιμασία διέγερσης ασβεστίου. Ο διαγνωστικός έλεγχος αυτών των ασθενών περιλαμβάνει το λεπτομερές και σε βάθος οικογενειακό ιστορικό, που θα διερευνά για ευρήματα συμβατά με σύνδρομο ΜΕΝ2.
Η αμιγής οικογενής μορφή έχει σχετικά αργή εξέλιξη, ενώ αυτό που ανήκει στο σύνδρομ MEN2 ή ΜΕΝ3 είναι πιο επιθετικό, με χειρότερο εκείνο του ΜΕΝ3. Το μυελοειδές είναι πιο επιθετικό από όλα τα διαφοροποιημένα νεοπλάσματα του θυρεοειδούς. Δίνει μεταστάσεις στους λεμφαδένες, πρώτα στους κεντρικούς (επίπεδο VI) και μετά στους υπόλοιπους (επίπεδο III, IV, V). Το 60% των αρρώστων με σποραδικό μυελοειδές έχει ήδη λεμφαδενικές μεταστάσεις κατά την αρχική διάγνωση. Απομακρυσμένες μεταστάσεις εντοπίζονται στο ήπαρ, στον πνεύμονα και στα οστά.
Στο οικογενές μυελοειδές καρκίνωμα ο έλεγχος είναι πληρέστερος και μάλιστα προς την κατεύθυνση αποκλεισμού των συνδρόμων της πολλαπλής ενδοκρινικής νεοπλασίας. Το σύνδρομο MEN2 είναι πιο συχνό και αφορά τα 2/3 των οικογενών μυελοειδών καρκινωμάτων του θυρεοειδούς. Στο MEN2 συνυπάρχει φαιοχρωμοκύττωμα ή/και υπερπαραθυροειδισμός σε ποσοστό 42% και 35% των περιπτώσεων αντιστοίχως, όπως και επίσης ομαλός λειχήνας και αμυλοείδωση. Το σύνδρομο ΜΕΝ3 σχετίζεται με φαιοχρωμοκύττωμα με συχνότητα 50% των περιπτώσεων και νευρινώματα σε αναλογία 100% των ασθενών. Οι ασθενείς με σύνδρομο ΜΕΝ3 παρουσιάζουν επίσης σκελετικές ανωμαλίες (μαρφανοειδές σωματότυπος), διαταραχές οδοντοφυΐας, νευρινώματα βλεννογόνων, πάχυνση νεύρων και συγγενές μεγάκολο (νόσος Hirschprung).
Οι ασθενείς με MTC συνήθως εμφανίζονται με τραχηλική μάζα και ψηλαφητή αυχενική λεμφαδενοπάθεια. Λεμφαδενικές μεταστάσεις διαπιστώνονται στο 70% των ασθενών με ψηλαφητή νόσο. Σε ασθενείς με ετερόπλευρο ψηλαφητό μυελοειδές καρκίνωμα συνυπάρχει κεντρική λεμφαδενοπάθεια στο 81%, ομόπλευρη τραχηλική λεμφαδενοπάθεια στο 81% και ετερόπλευρη τραχηλική λεμφαδενοπάθεια στο 49% των περιπτώσεων. Επί αμφοτερόπλευρης εντόπισης της νόσου, κεντρική λεμφαδενοπάθεια διαπιστώνεται στο 78% των ασθενών, ενώ, γενικά, το 49% των ασθενών εμφανίζουν λεμφαδενική διασπορά.
Κλινική εικόνα
 Ο τοπικός πόνος στον τράχηλο είναι το πιο σύνηθες σύμπτωμα στους ασθενείς με MTC. Η τοπική επέκταση του όγκου και η διήθηση παρακείμενων ανατομικών δομών μπορεί να προκαλέσει συμπτώματα δυσφαγίας, δύσπνοιας ή βράγχους. Οι μακρινές αιματογενείς μεταστάσεις στο ήπαρ, στα οστά (συχνά οστεοβλαστικές) και στον πνεύμονα συμβαίνουν σε κατοπινή φάση κατά την εξέλιξη της νόσου. Οι μυελοειδείς όγκοι του θυρεοειδούς δεν εκκρίνουν μόνο καλσιτονίνη και καρκινοεμβρυονικό αντιγόνο (CEA), αλλά και άλλα πεπτίδια όπως είναι το σχετιζόμενο με το γονίδιο της καλσιτονίνης πεπτίδιο (CGRP), οι ισταμινιδάσες, οι προσταγλανδίνες Ε2 και F2α και η σεροτονίνη. Οι ασθενείς με εκτεταμένη μεταστατική διασπορά συχνά εκδηλώνουν διάρροια, Σε εκτεταμένη νόσο (λόγω παραγωγής αμινών, προσταγλανδινών ή πολυπεπτιδίων από τον όγκο) μπορεί να εμφανιστεί παράδοξη συμπτωματολογία όπως flushing και επίμονες διάρροιες (20%), οι οποίες οφείλονται στην αυξημένη εντερική κινητικότητα και την υπερέκκριση των εντερικών υγρών και ηλεκτρολυτών. Περίπου το 3% των ασθενών αναπτύσσουν σύνδρομο Cushing λόγω έκτοπης παραγωγής αδρενοκορτικοτρόπου ορμόνης (ACTH).
Ο τοπικός πόνος στον τράχηλο είναι το πιο σύνηθες σύμπτωμα στους ασθενείς με MTC. Η τοπική επέκταση του όγκου και η διήθηση παρακείμενων ανατομικών δομών μπορεί να προκαλέσει συμπτώματα δυσφαγίας, δύσπνοιας ή βράγχους. Οι μακρινές αιματογενείς μεταστάσεις στο ήπαρ, στα οστά (συχνά οστεοβλαστικές) και στον πνεύμονα συμβαίνουν σε κατοπινή φάση κατά την εξέλιξη της νόσου. Οι μυελοειδείς όγκοι του θυρεοειδούς δεν εκκρίνουν μόνο καλσιτονίνη και καρκινοεμβρυονικό αντιγόνο (CEA), αλλά και άλλα πεπτίδια όπως είναι το σχετιζόμενο με το γονίδιο της καλσιτονίνης πεπτίδιο (CGRP), οι ισταμινιδάσες, οι προσταγλανδίνες Ε2 και F2α και η σεροτονίνη. Οι ασθενείς με εκτεταμένη μεταστατική διασπορά συχνά εκδηλώνουν διάρροια, Σε εκτεταμένη νόσο (λόγω παραγωγής αμινών, προσταγλανδινών ή πολυπεπτιδίων από τον όγκο) μπορεί να εμφανιστεί παράδοξη συμπτωματολογία όπως flushing και επίμονες διάρροιες (20%), οι οποίες οφείλονται στην αυξημένη εντερική κινητικότητα και την υπερέκκριση των εντερικών υγρών και ηλεκτρολυτών. Περίπου το 3% των ασθενών αναπτύσσουν σύνδρομο Cushing λόγω έκτοπης παραγωγής αδρενοκορτικοτρόπου ορμόνης (ACTH).
Χειρουργική θεραπεία
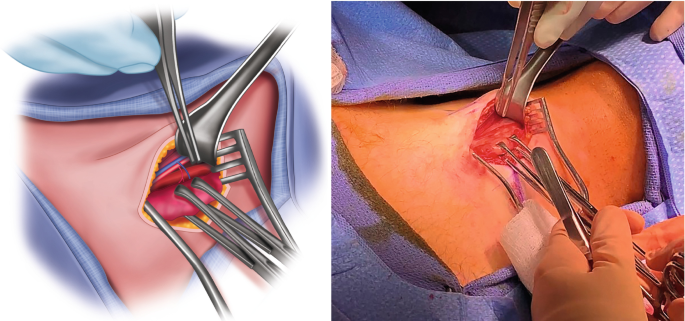 Η θεραπεία του MTC κατά βάση είναι χειρουργική και το αποτέλεσμα προσδιορίζεται από το στάδιο της νόσου, την επάρκεια και την ριζικότητα της αρχικής επέμβασης. Η αρχική επέμβαση θα πρέπει να είναι κατά το δυνατόν ριζική και περιλαμβάνει: α) την ολική θυρεοειδεκτομή και β) τον λεμφαδενικό καθαρισμό του τραχήλου, ο οποίος εκτείνεται σε όλα τα ανατομικά διαμερίσματα, ακόμη και στο μεσοθωράκιο. Το μυελοειδές καρκίνωμα σχετίζεται με υψηλή επίπτωση λεμφαδενικής διασποράς και ως εκ τούτου ο αμφοτερόπλευρος τραχηλικός λεμφαδενικός καθαρισμός θα πρέπει να εκτελείται ανεξαιρέτως σε όλους τους ασθενείς.
Η θεραπεία του MTC κατά βάση είναι χειρουργική και το αποτέλεσμα προσδιορίζεται από το στάδιο της νόσου, την επάρκεια και την ριζικότητα της αρχικής επέμβασης. Η αρχική επέμβαση θα πρέπει να είναι κατά το δυνατόν ριζική και περιλαμβάνει: α) την ολική θυρεοειδεκτομή και β) τον λεμφαδενικό καθαρισμό του τραχήλου, ο οποίος εκτείνεται σε όλα τα ανατομικά διαμερίσματα, ακόμη και στο μεσοθωράκιο. Το μυελοειδές καρκίνωμα σχετίζεται με υψηλή επίπτωση λεμφαδενικής διασποράς και ως εκ τούτου ο αμφοτερόπλευρος τραχηλικός λεμφαδενικός καθαρισμός θα πρέπει να εκτελείται ανεξαιρέτως σε όλους τους ασθενείς.
Η χειρουργική θεραπεία αφορά α) τις σποραδικές μορφές και β) τις οικογενείς μορφές. Διαφορές στην χειρουργική αντιμετώπιση στις δύο αυτές μορφές υφίστανται μόνο στις περιπτώσεις της προφυλακτικής θυρεοειδεκτομής σε ασθενείς με σύνδρομο MEN2 και MEN3. Από την αρχή είναι σημαντικό να διαλευκανθεί αν πρόκειται για σποραδικό ή οικογενές MTC στο πλαίσιο των συνδρόμων ΜΕΝ2 και ΜΕΝ3. Για αυτήν την διάκριση, εκτός από το οικογενειακό ιστορικό καθοριστικό ρόλο διαδραματίζει ο γενετικός έλεγχος του ογκογονιδίου RET. Επισημαίνεται ότι οι ασθενείς με ελεύθερο οικογενειακό ιστορικό, ενώ δηλαδή φαίνεται να πάσχουν από σποραδικό MTC, μετά τον γενετικό έλεγχο σε ποσοστό έως και 7% αποδεικνύεται να πάσχουν από οικογενές MTC. Με αυτόν τον τρόπο μπορούν να εντοπιστούν και άλλα μέλη της οικογένειας που είναι φορείς των μεταλλάξεων του ογκογονιδίου RET και να αντιμετωπιστούν καταλλήλως.
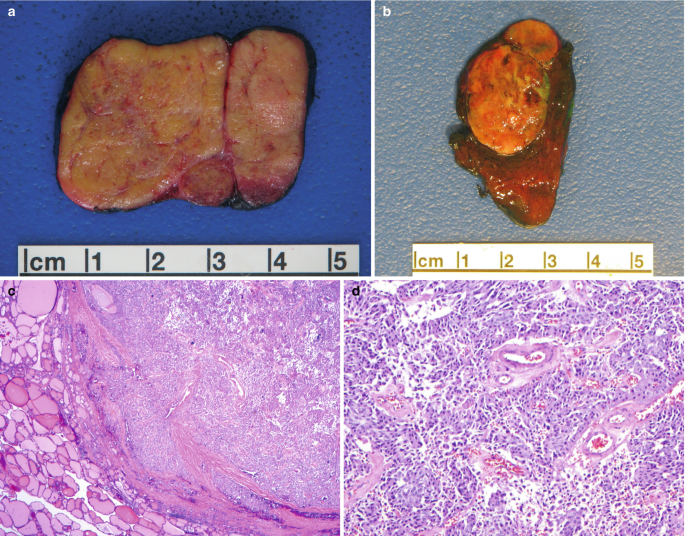 Πριν από την θυρεοειδεκτομή είναι σημαντικό να ελεγχθούν τα επινεφρίδια, ειδικά στους ασθενείς με σύνδρομο ΜΕΝ2, επειδή σε ποσοστό 50% αυτών των ασθενών συνυπάρχει και φαιοχρωμοκύττωμα (ΦΚ). Αν και το ΦΚ σπάνια είναι κακόηθες, στους ΜΕΝ2 ασθενείς υπάρχει ο κίνδυνος εκδήλωσης παροξυσμικής υπέρτασης κατά την διάρκεια της θυρεοειδεκτομής, που μπορεί να θέσει σε κίνδυνο την ζωή του ασθενούς. Παρά το γεγονός ότι το ΦΚ συνήθως εμφανίζεται 5-10 χρόνια μετά την διάγνωση του MTC, σε αρκετές περιπτώσεις διαγιγνώσκεται ταυτόχρονα. Ενδέχεται η διάγνωση του ΦΚ να προηγείται του MTC. Σε συνύπαρξη MTC και ΦΚ προηγείται η χειρουργική αφαίρεση του φαιοχρωμοκυττώματος και ακολουθεί σε δεύτερο χρόνο η θυρεοειδεκτομή.
Πριν από την θυρεοειδεκτομή είναι σημαντικό να ελεγχθούν τα επινεφρίδια, ειδικά στους ασθενείς με σύνδρομο ΜΕΝ2, επειδή σε ποσοστό 50% αυτών των ασθενών συνυπάρχει και φαιοχρωμοκύττωμα (ΦΚ). Αν και το ΦΚ σπάνια είναι κακόηθες, στους ΜΕΝ2 ασθενείς υπάρχει ο κίνδυνος εκδήλωσης παροξυσμικής υπέρτασης κατά την διάρκεια της θυρεοειδεκτομής, που μπορεί να θέσει σε κίνδυνο την ζωή του ασθενούς. Παρά το γεγονός ότι το ΦΚ συνήθως εμφανίζεται 5-10 χρόνια μετά την διάγνωση του MTC, σε αρκετές περιπτώσεις διαγιγνώσκεται ταυτόχρονα. Ενδέχεται η διάγνωση του ΦΚ να προηγείται του MTC. Σε συνύπαρξη MTC και ΦΚ προηγείται η χειρουργική αφαίρεση του φαιοχρωμοκυττώματος και ακολουθεί σε δεύτερο χρόνο η θυρεοειδεκτομή.
Τέλος, προσοχή θα πρέπει να δοθεί στην πιθανότητα συνύπαρξης MTC και πρωτοπαθούς υπερπαραθυρεοειδισμού (ΠΥΠ) στους ασθενείς με σύνδρομο ΜΕΝ2. Ο ΠΥΠ που συνοδεύει το MTC στο σύνδρομο MEN2 κατά κανόνα είναι ήπιος και ασυμπτωματικός και μπορεί να αφορά υπερπλασία και αδενώματα των παραθυρεοειδών αδένων. Λόγω της ασταθούς και ασύμμετρης φύσης της νόσου του ΠΥΠ στους ΜΕΝ2 ασθενείς, οι υποτροπές του ΠΥΠ δεν είναι σπάνιες.
Τύποι χειρουργικής επέμβασης
Η χειρουργική θεραπεία των ασθενών με MTC διακρίνεται σε: α) προφυλακτική και β) θεραπευτική. Η προφυλακτική χειρουργική αναφέρεται σε ασθενείς με διαπιστωμένη μετάλλαξη στο ογκογονίδιο RET (παιδικής ή εφηβικής κυρίως ηλικίας) στο πλαίσιο του συνδρόμου ΜΕΝ2 και πραγματοποιείται πριν εμφανιστεί το MTC. Η θεραπευτική χειρουργική αφορά τα ήδη διαγνωσμένα σποραδικά περιστατικά και τους ασθενείς με σύνδρομο ΜΕΝ2 που δεν διαγνώστηκε ή δεν αντιμετωπίστηκε έγκαιρα η νόσος.
Θεραπευτική θυρεοειδεκτομή
Η έκταση της θεραπευτικής θυρεοειδεκτομής απορρέει από την βιολογική συμπεριφορά του MTC, το οποίο δίνει νωρίς λεμφαδενικές μεταστάσεις. Η ελάχιστη σε έκταση επέμβαση είναι η ολική θυρεοειδεκτομή με κεντρικό τραχηλικό λεμφαδενικό καθαρισμό. Οι παράγοντες που θα πρέπει να λάβει υπ’ όψη ο χειρουργός πριν αποφασίσει το εύρος του λεμφαδενικού καθαρισμού είναι η τιμή της καλσιτονίνης, η προεγχειρητική απεικονιστική χαρτογράφηση των λεμφαδένων και το είδος της υποκείμενης μετάλλαξης στους ασθενείς με σύνδρομο ΜΕΝ2. Επισημαίνεται ότι η συχνότητα μεταστάσεων στους λεμφαδένες του πλαγίου διαμερίσματος σχετίζεται με τον αριθμό των διηθημένων λεμφαδένων στο κεντρικό διαμέρισμα. Αν δεν υπάρχουν διηθημένοι λεμφαδένες στο κεντρικό διαμέρισμα η πιθανότητα να υπάρχουν στο σύστοιχο πλάγιο είναι 10%, ενώ για 1-3 και >4 διηθημένους λεμφαδένες στο κεντρικό διαμέρισμα η πιθανότητα διηθημένων λεμφαδένων στο σύστοιχο πλάγιο είναι 77% και 98% αντίστοιχα. Ο λεμφαδενικός καθαρισμός περιλαμβάνει το σύνολο του τραχηλικού διαμερίσματος και όχι μόνο επιλεκτικά τους διηθημένους λεμφαδένες.
Στις σποραδικές μορφές του MTC η ολική θυρεοειδεκτομή είναι η θεραπεία εκλογής εξαιτίας της υψηλής επίπτωσης της πολυεστιακότητας, της επιθετικής βιολογικής συμπεριφοράς και επειδή η θεραπεία με ραδιενεργό ιώδιο είναι αναποτελεσματική. Οι λεμφαδένες του κεντρικού τμήματος συχνά διηθούνται νωρίς στην εξέλιξη της νόσου. Σε όγκους MTC μεγέθους >1,5 cm ποσοστό >60% των ασθενών έχουν μεταστάσεις στους ομόπλευρους λεμφαδένες, ενώ το 30% έχουν ταυτόχρονα μεταστάσεις και στους ετερόπλευρους λεμφαδένες. Για τους λόγους αυτούς σε όλους τους ασθενείς με MTC θα πρέπει να γίνεται τροποποιημένος λεμφαδενικός καθαρισμός του τραχήλου.
Ο λεμφαδενικός καθαρισμός, όμως, αυξάνει την πιθανότητα ιατρογενούς κάκωσης των λαρυγγικών νεύρων καθώς και το ενδεχόμενο εγκατάστασης ιατρογενούς υποπαραθυρεοειδισμού. Εάν η αγγειακή τροφοδοσία σε έναν παραθυρεοειδή αδένα αποκοπεί, τότε ο αδένας αυτός αφαιρείται, γίνεται βιοψία για την ιστολογική επιβεβαίωση και ακολούθως γίνεται αυτομεταμόσχευση στο αντιβράχιο του μη επικρατούντος χεριού στους ασθενείς με ΜΕΝ2, γιατί είναι πιθανό οι ασθενείς αυτοί να αναπτύξουν υπερπαραθυρεοειδισμό αποδιδόμενο στο εμφύτευμα. Στους άλλους ασθενείς η εμφύτευση γίνεται στον στερνοκλειδομαστοειδή μυ.
Αν ένας ασθενής με MTC εμφανίζει ταυτόχρονα και υπερασβεστιαιμία λόγω υπερπαραθυρεοειδισμού, τότε κατά την εγχείρηση της θυρεοειδεκτομής αφαιρούνται επιλεκτικά μόνο οι διογκωμένοι παραθυρεοειδείς αδένες, ενώ οι φυσιολογικοί παραθυρεοειδείς διατηρούνται. Τονίζεται ότι μόνο το 20% των ασθενών με ΜΕΝ2 αναπτύσσει υπερπαραθυρεοειδισμό. Οι εξαιρεθέντες παθολογικοί παραθυρεοειδείς αδένες μπορούν να διαφυλαχθούν σε συνθήκες κατάψυξης με σκοπό να αντιμετωπισθεί στο μέλλον ενδεχόμενος μόνιμος υποπαραθυρεοειδισμός, με αυτομεταμόσχευση. Σχεδόν το 95% των μοσχευμάτων επανακτούν πλήρη λειτουργικότητα εντός 4-6 εβδομάδων.
Προφυλακτική θυρεοειδεκτομή
Με τον όρο προφυλακτική θυρεοειδεκτομή εννοούμε την χειρουργική επέμβαση σε άτομα με γνωστή μετάλλαξη του ογκογονιδίου RET. Η επέμβαση αυτή πρέπει να γίνει έγκαιρα, την κατάλληλη περίοδο, πριν εκδηλωθεί το MTC ή αν έχει εκδηλωθεί να περιορίζεται στον θυρεοειδή αδένα, χωρίς εξωθυρεοειδική διασπορά.
Όλα τα μέλη της οικογένειας του ασθενούς με MTC θα πρέπει να ελεγχθούν για μετάλλαξη στο RET ογκογονίδιο. Επί θετικού ευρήματος, οι φορείς του μεταλλαγμένου ογκογονιδίου θα πρέπει να υποβληθούν σε προφυλακτική θυρεοειδεκτομή. Οι μεταλλάξεις του RET ταξινομούνται: α) σε πολύ υψηλού κινδύνου (highest risk), β) υψηλού κινδύνου (high risk) και γ) ενδιάμεσου κινδύνου (moderate risk).
Οι ασθενείς με πολύ υψηλό κίνδυνο είναι φορείς της μετάλλαξης Μ918Τ, δηλαδή οι ΜΕΝ3 ασθενείς. Σ’ αυτούς τους ασθενείς η θυρεοειδεκτομή συστήνεται να γίνει τους πρώτους μήνες της ζωής, επειδή μπορεί να υπάρχει MTC ήδη από το πρώτο έτος της ζωής και να έχει δώσει λεμφαδενικές μεταστάσεις ή ακόμα και απομακρυσμένες μεταστάσεις σε άλλα όργανα. Η χειρουργική επέμβαση θεωρείται θεραπευτική αν πραγματοποιηθεί πριν την ηλικία των 4 ετών. Ο παιδίατρος μπορεί να υποψιασθεί την διάγνωση από κάποια πρώιμα συμπτώματα στο νεογνό. Σε αυτά ανήκουν η ξηροφθαλμία λόγω μειωμένης ευαισθησίας στον κερατοειδή, τα προβλήματα θηλασμού λόγω αδυναμίας σύλληψης της θηλής από το νεογνό απότοκο των χαρακτηριστικών νευρωμάτων στα χείλη και τέλος σοβαρή δυσκοιλιότητα οφειλόμενη στα νευρινώματα του γαστρεντερικού σωλήνα.
Στην ομάδα υψηλού κινδύνου περιλαμβάνονται οι ασθενείς με μεταλλάξεις στο κωδικόνιο 634 και στο Α883F. Οι πρώτοι αφορούν τους ασθενείς με σύνδρομο ΜΕΝ2, ενώ οι δεύτεροι τους ασθενείς με MEN3. Στην κατηγορία αυτή των ασθενών η θυρεοειδεκτομή προτείνεται πριν τα 5 έτη, εκτός και αν υπάρχει νωρίτερα αύξηση της καλσιτονίνης. Σε κάθε περίπτωση έλεγχος για τα επίπεδα της καλσιτονίνης πρέπει να γίνεται μετά την ηλικία των 3 ετών.
Στην ομάδα ενδιάμεσου κινδύνου η θυρεοειδεκτομή προτείνεται να γίνεται πριν την εμφάνιση του μυελοειδούς καρκινώματος. Ο έλεγχος της καλσιτονίνης γίνεται μετά την ηλικία των 5 ετών οπότε και η θυρεοειδεκτομή πραγματοποιείται μετά την ηλικία αυτή και εφόσον υπάρχουν σαφείς ενδείξεις ανάπτυξης της νόσου. Οι αναθεωρημένες κατευθυντήριες οδηγίες προτείνουν ταυτόχρονο κεντρικό λεμφαδενικό καθαρισμό με την προφυλακτική ολική θυρεοειδεκτομή σε ασθενείς με τιμή καλσιτονίνης >40 pg/mL ή αν υπάρχει απεικονιστική υποψία λεμφαδενικής διασποράς. Σε κάθε περίπτωση η προφυλακτική θυρεοειδεκτομή πρέπει να διενεργείται στην μεγαλύτερη δυνατή ηλικία, πριν όμως την εμφάνιση της νόσου, κάτι που απαιτεί συνεχή επαγρύπνηση με παρακολούθηση της καλσιτονίνης και επιμελημένη απεικόνιση. Ο λόγος για την αποφυγή της θυρεοειδεκτομής σε μικρή ηλικία είναι το υψηλό ποσοστό των επιπλοκών.
Επανεπεμβάσεις για MTC
Όταν τα επίπεδα καλσιτονίνης ή του καρκινοεμβρυϊκού αντιγόνου (CEA)στον ορό παραμένουν αυξημένα μετά την θυρεοειδεκτομή, γίνεται έλεγχος με υπερηχογράφημα ή μαγνητική τομογραφία (MRI) του τραχήλου και του μεσοθωρακίου. Η λαπαροσκοπική έρευνα του ήπατος για την παρουσία κεγχροειδών μεταστάσεων συστήνεται σε ασθενείς με αυξημένα επίπεδα καλσιτονίνης. Εάν το ήπαρ είναι ελεύθερο νόσου, επιχειρείται τροποποιημένος λειτουργικός λεμφαδενικός καθαρισμός του τραχήλου, εάν δεν έχει ήδη προηγηθεί, με συναφαίρεση των λεμφαδένων του άνω μεσοθωρακίου.
Σε ασθενείς με τοπική υποτροπή του MTC επιχειρείται επανεπέμβαση. Η απόφαση για επανεπέμβαση βασίζεται κυρίως στα απεικονιστικά ευρήματα και στην τιμή της καλσιτονίνης. Μπορεί να έχει θεραπευτικό ή παρηγορικό σκοπό. Στις παρηγορικές επεμβάσεις επιχειρείται ογκομειωτική επέμβαση, όχι μόνο για να βελτιωθούν τα συμπτώματα της έξαψης και της διάρροιας αλλά και για να μειωθεί ο κίνδυνος του ασφυκτικού θανάτου, από υποτροπή της νόσου στον κεντρικό τράχηλο ή στο μεσοθωράκιο.
Επικουρική θεραπεία
To MTC δεν ανταποκρίνεται στην θεραπεία με ραδιενεργό ιώδιο-131, ενώ οι υπόλοιπες συμπληρωματικές θεραπείες χρησιμοποιούνται μόνο στο πλαίσιο κλινικών δοκιμών. Ωστόσο μερικοί επιχειρούν την θεραπεία με ραδιενεργό ιώδιο, με την σκέψη ότι προσλαμβάνεται από το υγιές θυρεοειδικό παρέγχυμα και από την θέση αυτή ακτινοβολεί προς μικρές νησίδες καρκινικού ιστού που τυχόν υπάρχουν ανάμεσά του.
Οι τοπικές θεραπείες οι οποίες στοχεύουν σε συγκεκριμένες μεταστατικές εστίες, μπορεί να ελέγξουν τοπικά τόσο την νόσο όσο και την συμπτωματολογία, να βελτιώσουν την ποιότητα ζωής και να καθυστερήσουν την έναρξη συστηματικής θεραπείας. Σε ασθενείς με τοπική υποτροπή της νόσου, η κύρια θεραπεία είναι η χειρουργική επέμβαση, πριν από την οποία πρέπει να ληφθεί υπόψη η έκταση του όγκου καθώς και η παρουσία μακρινών μεταστάσεων. Δεν διατίθεται κανένα αποτελεσματικό χημειοθεραπευτικό σχήμα.
Σε διηθητικούς όγκους που θέτουν σε κίνδυνο τον αεραγωγό μπορεί να γίνει εξωτερική ακτινοβόληση. Για ηπατικές μεταστάσεις μπορεί να χρησιμοποιηθεί ο χημειοεμβολισμός για την μείωση της μάζας και των συμπτωμάτων του όγκου και είναι αποτελεσματικός σε βλάβες μεγέθους <3cm. Η εξωτερική ακτινοθεραπεία σε οστικές μεταστάσεις μπορεί να προσφέρει ανακούφιση από τον πόνο, προστασία από κατάγματα και διατήρηση της κινητικότητας. Εξωτερική ακτινοθεραπεία στο μεσοθωράκιο μπορεί να χρησιμοποιηθεί για την αποφυγή πιεστικών συμπτωμάτων από την τραχεία. Για εγκεφαλικές μεταστάσεις μπορεί να χρησιμοποιηθεί χειρουργική επέμβαση ή/και στερεοτακτική ακτινοβόληση (γ- ή cyber knife). Η κατάλυση με ραδιοσυχνότητες έχει επίσης χρησιμοποιηθεί σε λεμφαδενικές, πνευμονικές, ηπατικές μεταστάσεις. Η λαπαροσκοπική αντιμετώπιση με ραδιοσυχνότητα συμβάλλει στην παρηγορική θεραπεία των ηπατικών μεταστάσεων που έχουν μέγεθος >1,5 cm. Οι τοπικές θεραπείες κατά προτίμηση χρησιμοποιούνται πριν από την έναρξη της συστηματικής θεραπείας.
Στοχευμένες θεραπείες
 Για το μικρό ποσοστό ασθενών με εξελισσόμενη μεταστατική νόσο τόσο σε σποραδικά όσο και σε οικογενή MTC, οι νέες στοχευμένες θεραπείες με τους αναστολείς τυροσινικών κινασών είναι πολλά υποσχόμενες καθώς προσφέρουν μακροχρόνια σταθεροποίηση νόσου στους ασθενείς υψηλού κινδύνου (Tyrosine Kinase Inhibitors, TKI). Δεδομένου όμως ότι η πλειονότητα των MTC εξελίσσεται βραδέως, είναι απαραίτητη η προσεκτική επιλογή του χρόνου έναρξης της συστηματικής θεραπείας. Με βάση τις επικαιροποιημένες κατευθυντήριες οδηγίες, ΤΚΙ χορηγούνται στις σπάνιες περιπτώσεις με προχωρημένη, συμπτωματική ή ταχέως εξελισσόμενη μεταστατική νόσο (εξέλιξη της νόσου σε ≤1 έτος) και με σημαντικό φορτίο όγκου με πολλαπλές μετρήσιμες μεταστατικές βλάβες. Επιπλέον ενδείξεις είναι η μη εξαιρέσιμη τοπική νόσος λόγω διήθησης γειτονικών οργάνων, η συμπτωματική νόσος, ο κίνδυνος πίεσης ζωτικών ανατομικών δομών όπως και η εμφάνιση απομακρυσμένων μεταστάσεων σε ζωτικά όργανα (π.χ. ήπαρ). Δεν συστήνεται θεραπεία με ΤΚΙ σε ασθενείς μόνο με βιοχημική πρόοδο, χωρίς δομική πρόοδο ή σε ασυμπτωματικούς ασθενείς με μικρές μεταστατικές βλάβες και χωρίς ενδείξεις προόδου. Ο στόχος αυτών των θεραπειών είναι κυρίως η βελτίωση της ποιότητας ζωής και, επιπλέον, η επιμήκυνση της επιβίωσης. Θα πρέπει επίσης να αποφεύγονται σε περιπτώσεις ασθενών με συννοσηρότητες ή μετά από πρόσφατη εξωτερική ακτινοβολία.
Για το μικρό ποσοστό ασθενών με εξελισσόμενη μεταστατική νόσο τόσο σε σποραδικά όσο και σε οικογενή MTC, οι νέες στοχευμένες θεραπείες με τους αναστολείς τυροσινικών κινασών είναι πολλά υποσχόμενες καθώς προσφέρουν μακροχρόνια σταθεροποίηση νόσου στους ασθενείς υψηλού κινδύνου (Tyrosine Kinase Inhibitors, TKI). Δεδομένου όμως ότι η πλειονότητα των MTC εξελίσσεται βραδέως, είναι απαραίτητη η προσεκτική επιλογή του χρόνου έναρξης της συστηματικής θεραπείας. Με βάση τις επικαιροποιημένες κατευθυντήριες οδηγίες, ΤΚΙ χορηγούνται στις σπάνιες περιπτώσεις με προχωρημένη, συμπτωματική ή ταχέως εξελισσόμενη μεταστατική νόσο (εξέλιξη της νόσου σε ≤1 έτος) και με σημαντικό φορτίο όγκου με πολλαπλές μετρήσιμες μεταστατικές βλάβες. Επιπλέον ενδείξεις είναι η μη εξαιρέσιμη τοπική νόσος λόγω διήθησης γειτονικών οργάνων, η συμπτωματική νόσος, ο κίνδυνος πίεσης ζωτικών ανατομικών δομών όπως και η εμφάνιση απομακρυσμένων μεταστάσεων σε ζωτικά όργανα (π.χ. ήπαρ). Δεν συστήνεται θεραπεία με ΤΚΙ σε ασθενείς μόνο με βιοχημική πρόοδο, χωρίς δομική πρόοδο ή σε ασυμπτωματικούς ασθενείς με μικρές μεταστατικές βλάβες και χωρίς ενδείξεις προόδου. Ο στόχος αυτών των θεραπειών είναι κυρίως η βελτίωση της ποιότητας ζωής και, επιπλέον, η επιμήκυνση της επιβίωσης. Θα πρέπει επίσης να αποφεύγονται σε περιπτώσεις ασθενών με συννοσηρότητες ή μετά από πρόσφατη εξωτερική ακτινοβολία.
Η κατανόηση των μοριακών μηχανισμών ογκογένεσης MTC έχει παίξει καθοριστικό ρόλο στην ανάπτυξη των νέων στοχευμένων θεραπειών. Διάφορα TKI έχουν χρησιμοποιηθεί επιτυχώς για την θεραπεία του μεταστατικού MTC. Οι κύριοι μοριακοί στόχοι είναι υποδοχείς με δραστηριότητα κινάσης τυροσίνης όπως είναι ο RET και VEGFR (υποδοχέας του αγγειακού ενδοθηλιακού αυξητικού παράγοντα), ο οποίος υπερεκφράζεται τόσο στα καρκινικά κύτταρα όσο και στο ενδοθήλιο των αγγείων του όγκου. Οι μεταλλάξεις RET είναι μείζονος σημασίας για την παθογένεση όχι μόνο του οικογενούς MTC αλλά και του σποραδικού MTC. Μεταλλάξεις RET ανιχνεύονται σε ποσοστό >95% των οικογενών MTC ενώ στα σποραδικά ανευρίσκονται ως σωματικές μεταλλάξεις σε ποσοστό 45%. Η πιο συνηθισμένη θέση στο RET είναι στο κωδικόνιο M918T σε ποσοστό 85%. Η συγκεκριμένη θέση μετάλλαξης (η οποία είναι παθογνωμονική του συνδρόμου ΜΕΝ3) σχετίζεται με υψηλότερο ρυθμό πολλαπλασιασμού και δυσμενέστερη πρόγνωση. Σε σποραδικά MTC που δεν φέρουν μεταλλάξεις RET μπορεί να ανιχνευθούν μεταλλάξεις RAS (10%). Πέραν αυτών, στην ογκογένεση του MTC φαίνεται ότι συμμετέχουν και άλλες ενδοκυττάριες οδοί ή μεταλλάξεις και άλλων παραγόντων όπως των ΜΕΤ, του αυξητικού παράγοντα c-MET/ηπατοκυττάρων (HGF), των παραγόντων RAS και mTOR, του FGFR (υποδοχέα του αυξητικού παράγοντα ινοβλαστών) κ.α.
Δύο αναστολείς τυροσινικών κινασών το vandetanib και το cabozantinib έχουν εγκριθεί για το ταχέως εξελισσόμενο μεταστατικό MTC. Το vandetanib αναστέλλει τους VEGFR2, VEGFR3, RET, EGFR, ενώ το cabozantinib αναστέλλει τους υποδοχείς RET, VEGFR2 και c-met. Και τα δύο φάρμακα αναστέλλουν ισχυρότερα τον VEGF και λιγότερο τον RET υποδοχέα. Η χορήγησή τους έχει αποτελεσματικότητα με σταθεροποίηση της νόσου στο 30% και μερική δομική απάντηση στο 35% των περιπτώσεων. Θα πρέπει ωστόσο να σημειωθεί ότι η εκτίμηση του οφέλους της θεραπείας με αυτούς τους παράγοντες στην συνολική επιβίωση είναι δύσκολο να αποτιμηθεί, δεδομένου ότι η πλειονότητα των ασθενών έχει σχετικά μεγάλο προσδόκιμο ζωής. Η απάντηση στην θεραπεία διαρκεί για κυμαινόμενο χρονικό διάστημα, καθώς κατά την διάρκεια της θεραπείας μπορεί να συμβεί αντίσταση στην δράση των φαρμάκων αυτών. Η παρουσία μετάλλαξης RET τόσο στις οικογενείς περιπτώσεις αλλά και σε σωματικά κύτταρα του όγκου μπορεί να είναι ευνοϊκή ως προς την απάντηση στην θεραπεία.
Οι μηχανισμοί αντίστασης δεν είναι διακριβωμένοι. Πιθανολογείται είτε η εμφάνιση νέων μεταλλάξεων είτε η ενεργοποίηση κάποιου παράλληλου ογκογενετικού μονοπατιού. Υπάρχουν μεταλλάξεις σε ορισμένες θέσεις του ογκογονιδίου RET όπως στο κωδικόνιο 804 οι οποίες σχετίζονται με αντίσταση στην δράση των ΤΚΙ (vandetanib, cabozantintinib). Επί αστοχίας στην συστηματική θεραπεία πρώτης γραμμής, συνιστάται η χορήγηση δευτέρας γραμμής αγωγή με άλλο ΤΚΙ. Επισημαίνεται ότι η πτώση της τιμής της καλσιτονίνης δεν σημαίνει πάντα και δομική ανταπόκριση. Η παραγωγή της καλσιτονίνης διαμεσολαβείται μέσω των ίδιων μονοπατιών που αναστέλλουν τα ΤΚΙ. Η θεραπεία με TKI θα πρέπει να διακόπτεται όταν δεν υπάρχει κλινικό όφελος ή όταν συμβεί πρόοδος νόσου υπό αγωγή. Όταν εμφανιστούν σοβαρές ανεπιθύμητες ενέργειες, το φάρμακο διακόπτεται ή συνεχίζεται σε μειωμένες δόσεις.
Τα φάρμακα αυτά έχουν σε υψηλό ποσοστό σοβαρές ανεπιθύμητες ενέργειες (30-60% των ασθενών), οι οποίες μπορεί να επηρεάσουν δυσμενώς την ποιότητα ζωής των ασθενών. Γενικά μη ειδικά συμπτώματα (κόπωση, ναυτία, πονοκέφαλος, μυοσκελετικός πόνος), δερματικές ανεπιθύμητες ενέργειες (εξανθήματα, ξηρότητα δέρματος, φωτοευαισθησία, θυλακίτιδα που προκαλούνται συχνότερα από το vandetanib και ερυθροδυσαισθησία παλαμών – πελμάτων, βλεννογονίτιδες που προκαλούνται συχνότερα από το cabozantinib), γαστρεντερικά συμπτώματα (μειωμένη όρεξη και μείωση σωματικού βάρους, έμετοι, διάρροια, δυσκοιλιότητα, κοιλιακό άλγος), καθώς και αρτηριακή υπέρταση, υποκαλιαιμία και αύξηση της TSH είναι μεν συχνές, αντιμετωπίζονται όμως ανάλογα με την συμπτωματολογία και τα κλινικά και εργαστηριακά ευρήματα συμπτωματικά. Πολύ σοβαρές ανεπιθύμητες ενέργειες απειλητικές για την ζωή εμφανίζονται στο 2% των ασθενών. Εξ αυτών οι σοβαρότερες είναι η παράταση του διαστήματος QT και ο κίνδυνος για κοιλιακή ταχυκαρδία που προκαλείται από το vandetanib και η ανάπτυξη γαστρεντερικών συριγγίων και η απειλητική για την ζωή αιμορραγία που προκύπτει από την χρήση του cabozantinib.
Στην θεραπευτική φαρέτρα έχει ενταχθεί και ο εκλεκτικός anti-RET αναστολέας selpercatinib σε ασθενείς που φέρουν μετάλλαξη RET. Το φάρμακο αυτό έχει εξαιρετική αποτελεσματικότητα και πολύ ασφαλές προφίλ από πλευράς ανεπιθύμητων ενεργειών σε ασθενείς με α) MTC και μετάλλαξη RET αλλά και β) σε ασθενείς με διαφοροποιημένο θυλακιοκυτταρικό θυρεοειδικό καρκίνωμα και αναδιάταξη RET/PTC. Το φάρμακο αυτό επιτυγχάνει αναστολή της προόδου της νόσου σε ένα έτος χορήγησης 92% και η απάντηση στην αγωγή είναι 69%. Επιπλέον το φάρμακο είναι αποτελεσματικό και σε ασθενείς με μετάλλαξη στην θέση 804, η οποία σχετίζεται με αντίσταση στην θεραπεία με τους άλλους παράγοντες. Άλλο ένα πλεονέκτημα είναι η ενδεχόμενη αποτελεσματικότητα του φαρμάκου σε εγκεφαλικές μεταστάσεις. Αυτό οφείλεται στο γεγονός ότι το μόριο είναι μικρό και δύναται να διέλθει μέσω του αιματοεγκεφαλικού φραγμού στον εγκέφαλο. Εξίσου σημαντικό είναι το προφίλ ασφάλειας του φαρμάκου καθώς έχει ήπιες ανεπιθύμητες ενέργειες, όπως υπέρταση, διάρροια, κόπωση και τρανσαμινασαιμία. Ένα δεύτερο πολλά υποσχόμενο φάρμακο της ίδιας κατηγορίας είναι και το pRASeltinib (BLU-667). Ωστόσο, νέοι αναστολείς τυροσινικών κινασών βρίσκονται υπό κλινικές δοκιμές.
Θεραπείες με αντισώματα (anti-CEA Ab), παράγοντες σημασμένοι με ραδιονουκλίδια (90Yttrium-DOTATOC, 177Lu-DOTATATE (έχουν έγκριση για νευροενδοκρινή νεοπλάσματα) και ανοσοθεραπείες είναι υπό μελέτη. Σε ασθενείς με μεταστατικό MTC στους οποίους χορηγήθηκε θεραπεία με ραδιονουκλίδια, μόνο εκείνοι που είχαν υψηλή πρόσληψη στο octreoscan (αυξημένη έκφραση των υποδοχέων σωματοστατίνης) είχαν σχετική σταθεροποίηση της νόσου σε ποσοστό 12% και κυρίως αυτοί στους οποίους χορηγήθηκε 177Lu-octreotate. Η κλασική κυτταροτοξική χημειοθεραπεία μπορεί να μειώσει την πρόοδο σε λιγότερο από 10% των ασθενών, αλλά δεν παρατείνει την επιβίωση και δεν χρησιμοποιείται.
Συμπερασματικά, η βελτίωση των διαγνωστικών μεθόδων για το MTC, ο γενετικός έλεγχος και οι γνώσεις μας για την μοριακή παθογένεια του MTC έχουν βελτιώσει κατά πολύ την πρόγνωση των ασθενών αυτών τα τελευταία χρόνια. Οι νέες εξελίξεις έχουν αλλάξει τις θεραπευτικές στρατηγικές στην αντιμετώπιση του MTC. Ήδη κατά την τελευταία δεκαετία χρησιμοποιούνται στοχευμένες θεραπείες. Οι αναστολείς της τυροσίνης κινάσης και οι εκλεκτικοί αναστολείς RET αποτελούν σημαντική πρόοδο στην διαχείριση αυτών των ασθενών με μακρινές μεταστάσεις και εξελισσόμενη νόσο.
Παρακολούθηση
Η παρακολούθηση των επιπέδων καλσιτονίνης στο αίμα αποτελεί την πιο ευαίσθητη μέθοδο έγκαιρης αναγνώρισης της υποτροπής σε ασθενείς με χειρουργημένο MTC. Οι ασθενείς μπορεί να έχουν τοπικο-περιοχική νόσο ή απομακρυσμένες μεταστάσεις ως αρχική εκδήλωση της υποτροπής.
Επίπεδα καλσιτονίνης άνω των 1000 pg/ml φανερώνουν με βεβαιότητα μεταστατική νόσο. Οι ασθενείς με μετεγχειρητικά επίπεδα καλσιτονίνης >400 pg/ml μάλλον έχουν μακρινές μεταστάσεις. Επί μεταστατικής νόσου η 10ετής επιβίωση υπολογίζεται στο 30%. Ωστόσο, οι ασθενείς με απομακρυσμένες μικρομεταστάσεις συχνά παρουσιάζουν μεγάλες χρονικές περιόδους βραδέως εξελισσόμενης ασυμπτωματικής νόσου. Συστηματική επανασταδιοποίηση πρέπει να γίνεται στους ασθενείς με αυξημένα μετεγχειρητικά επίπεδα καλσιτονίνης >100-200 pg/ml, ακόμη και επί επιβεβαιωμένης μεταστατικής νόσου.
Τα επίπεδα καλσιτονίνης και CEA αξιολογούνται κάθε 6-12 μήνες. Εάν η καλσιτονίνη στο αίμα δεν είναι αυξημένη, επαναλαμβάνεται ο έλεγχος των βασικών επιπέδων καλσιτονίνης, καθώς επίσης και των επιπέδων της μετά από διέγερση με ασβέστιο, μια φορά τον χρόνο για 5 έτη.
Θα πρέπει να σημειωθεί ότι τα επίπεδα καλσιτονίνης μπορεί να παρουσιάζουν διακύμανση κατά 20-30% σε διαδοχικές μετρήσεις, χωρίς αυτό να υποδηλώνει πρόοδο νόσου. Σπάνια το CEA μπορεί να αυξηθεί προοδευτικά χωρίς ταυτόχρονη αύξηση των επιπέδων της καλσιτονίνης. Αυτό μπορεί να υποδηλώνει αποδιαφοροποίηση του όγκου και χρήζει απεικονιστικής διερεύνησης.
Η πρόοδος της νόσου εκτιμάται και απεικονιστικά. Οι κατάλληλες απεικονιστικές μέθοδοι για κάθε όργανο μπορεί να αποκαλύψουν πιθανές μεταστατικές εστίες. Το υπερηχογράφημα υψηλής ευκρίνειας του τραχήλου σε συνδυασμό με την ελαστογραφία από έμπειρο ακτινολόγο, θεωρείται ως η πιο ευαίσθητη μέθοδος για την ανάδειξη υπολειμματικής νόσου ή τοπικής υποτροπής. Η αξονική τομογραφία είναι κατάλληλη για τον τράχηλο, τον θώρακα και την κοιλία ενώ η μαγνητική τομογραφία για το ήπαρ, τα οστά και τον εγκέφαλο. Το F-DOPA-PET / CT δεν είναι αξιόπιστο στις περισσότερες περιπτώσεις MTC, αν και έχει κάποια χρήση μόνο σε ασθενείς με υψηλά αυξημένα επίπεδα καλσιτονίνης >1000 pg/mL και με ταχύ ρυθμό εξέλιξης της νόσου. Η αποδεδειγμένη απεικονιστική πρόοδος της νόσου αποτελεί ένδειξη για συστηματική θεραπεία και επιπλέον χρησιμεύει για την εκτίμηση της απάντησης στην θεραπεία. Οι συχνότερες μεταστατικές θέσεις είναι οι λεμφαδένες του τραχήλου και του μεσοθωρακίου, το ήπαρ, οι πνεύμονες και τα οστά.
Πρόγνωση
Η πρόγνωση του MTC έχει βελτιωθεί αισθητά κατά τα τελευταία χρόνια και αυτό αποδίδεται στους εξής παράγοντες: α) στην πρώιμη διάγνωση με την συμβολή ευαίσθητων μεθόδων ανίχνευσης όπως είναι η μέτρηση της καλσιτονίνης και το υπερηχογράφημα υψηλής ευκρίνειας σε συνδυασμό με την ελαστογραφία, β) στην ευρεία εφαρμογή του γενετικού ελέγχου που βοηθά τόσο στην αποκάλυψη οικογενών μορφών όσο και στην έγκαιρη ανίχνευση των φορέων με μετάλλαξη RET, γ) στις νέες στοχευμένες θεραπείες. Η πρωταρχική θεραπεία εκλογής του MTC είναι η ολική θυρεοειδεκτομή σε συνδυασμό με τον ταυτόχρονο λεμφαδενικό καθαρισμό, δεδομένου ότι οι λεμφαδενικές μεταστάσεις είναι συχνές κατά την αρχική διάγνωση της νόσου.
Οι κύριοι προγνωστικοί παράγοντες επιβίωσης και προόδου της νόσου είναι το στάδιο της νόσου κατά την αρχική διάγνωση, τα προεγχειρητικά και τα μετεγχειρητικά επίπεδα καλσιτονίνης, όπως και ο χρόνος διπλασιασμού καλσιτονίνης και CEA.
Σε ασθενείς χωρίς λεμφαδενικές μεταστάσεις, η βιοχημική και κλινική ύφεση επιτυγχάνεται σε ποσοστό 82% των ασθενών, ενώ σε αυτούς με λεμφαδενικές μεταστάσεις μόνο το 25% θα παρουσιάσει ύφεση. Τα ποσοστά 10ετούς επιβίωσης είναι περίπου 80% αλλά μειώνονται στο 45% στους ασθενείς με διηθημένους λεμφαδένες. Αναλυτικότερα, όταν ο αριθμός των διηθημένων λεμφαδένων είναι >10, το ποσοστό πλήρους ύφεσης πέφτει στο 4%. Η 10ετής επιβίωση ασθενών σε στάδιο IV είναι <30%. Για αυτό, η πρόγνωση και το ποσοστό της 10ετούς επιβίωσης εξαρτώνται από την έγκαιρη διάγνωση και την ριζικότητα της αρχικής επέμβασης. Στην οικογενή νόσο η πρόγνωση είναι καλύτερη κυρίως λόγω της πρώιμης διάγνωσης, που γίνεται μέσω του γενετικού ελέγχου.
Οι ασθενείς με όγκους που η χρώση για καλσιτονίνη είναι φτωχή και με ετερογενή κατανομή της καλσιτονίνης πηγαίνουν χειρότερα από τους ασθενείς των οποίων η χρώση για καλσιτονίνη είναι αυξημένη και ομοιογενής. Η προγνωστική αξία των μετεγχειρητικών επιπέδων της καλσιτονίνης είναι μεγάλης σπουδαιότητας. Οι ασθενείς με μετεγχειρητικά χαμηλά ή μη ανιχνεύσιμα επίπεδα καλσιτονίνης και CEA έχουν άριστη πρόγνωση, με 10ετή επιβίωση >90%. Οι ασθενείς με μη ανιχνεύσιμα επίπεδα καλσιτονίνης έχουν πιθανότητα υποτροπής <3%, ενώ εκείνοι με μετρήσιμα μετεγχειρητικά επίπεδα καλσιτονίνης θεωρείται ότι έχουν υπολειμματική νόσο. Στις περιπτώσεις αυτές η πορεία της νόσου ποικίλει και ενδέχεται για πολλά χρόνια να υπάρχει υπολειπόμενη νόσος και οι ασθενείς να βιώνουν μακρά επιβίωση, χωρίς εξέλιξη της νόσου. Σε αυτούς η 10ετής επιβίωση είναι 85% ακόμη και χωρίς καμία θεραπευτική παρέμβαση.
Ο χρόνος διπλασιασμού των τιμών της καλσιτονίνης θεωρείται ισχυρός προγνωστικός παράγοντας για την εξέλιξη της νόσου και την επιβίωση. Όσο μικρότερο είναι το διάστημα διπλασιασμού των τιμών καλσιτονίνης τόσο χειρότερη είναι η πρόγνωση. Χρόνος διπλασιασμού της καλσιτονίνης και του CEA μικρότερος από 12 μήνες χαρακτηρίζει τους ασθενείς με υψηλό κίνδυνο εξέλιξης της νόσου και αυξημένο ποσοστό θνητότητας στην 5ετία. Όταν το διάστημα διπλασιασμού των τιμών καλσιτονίνης είναι μικρότερο των 6 μηνών οι ασθενείς έχουν πιθανότητα 10ετούς επιβίωσης 8%, ενώ όταν ο χρόνος διπλασιασμού υπερβαίνει τα δύο (2) έτη τότε η πιθανότητα 10ετούς επιβίωσης είναι 100%.
Υποτροπή
Μετά την εγχείρηση για μυελοειδές καρκίνωμα και την ιστολογική εξέταση οι ασθενείς δέον να παρακολουθούνται συστηματικά για πιθανή υποτροπή.
Όσον αφορά την υποτροπή, υπάρχει: α) ο επιμένων καρκίνος που παρατηρείται αύξηση καλσιτονίνης (χρησιμοποιείται σαν δείκτης υποτροπής) και β) ο υποτροπιάζων όπου είναι εμφανής η απεικονιστική παρουσία τοπικής ή απομακρυσμένης εστίας. Και στις δύο περιπτώσεις προτείνεται τροποποιημένος λεμφαδενικός καθαρισμός του τραχήλου με διαφύλαξη των λαρυγγικών νεύρων και των παραθυρεοειδών αδένων. Μετά την επανεγχείρηση παρατηρείται ίαση (βιοχημική) μόνο στο 38% των αρρώστων, η οποία σπάνια διατηρείται. Οι ασθενείς που χειρουργούνται για υποτροπή είναι υψηλού κινδύνου για νέα υποτροπή. Η αρχική ολική θυρεοειδεκτομή με συνοδό τραχηλικό λεμφαδενικό καθαρισμό φαίνεται να οριοθετεί την εξέλιξη του όγκου και να ελαττώνει το κίνδυνο για επανεπέμβαση.
Έχει βρεθεί ότι η τιμή της καλσιτονίνης παραμένει υψηλή στο 40% – 80% των χειρουργημένων ασθενών με MTC. Σε αυτές τις περιπτώσεις τίθεται η υποψία υποτροπής και πρέπει να γίνει έλεγχος της πρώτης εγχείρησης. Αν η τιμή της καλσιτονίνης είναι >1000 pg/ml δεν υπάρχει ίαση από την νόσο, ενώ εάν η καλσιτονίνη είναι <50, υπάρχει πιθανότητα ανακάλυψης της υποτροπής. Σε κάθε περίπτωση υψηλής τιμής καλσιτονίνης πρέπει να αποκλεισθούν άλλες μεταστάσεις.
Γενικότερα, για έλεγχο πιθανής υποτροπής μυελοειδούς Ca πρέπει να γίνουν τα εξής: α) μέτρηση καλσιτονίνης και CEA, β) αποκλεισμός συνδρόμων MEN2, MEN3, γ) εντοπισμός λεμφαδένων ( στο 75% υπάρχουν μικρομεταστάσεις) και δ) εφόσον εντοπιστεί η υποτροπή να ακολουθήσει συμπληρωματική επέμβαση
Επίσης πρέπει να γνωρίζουμε για το μυελοειδές καρκίνωμα του θυρεοειδούς, ότι:
- Το 10-30% των ασθενών παραμένουν ελεύθεροι νόσου.
- Το 80% εμφανίζουν υποτροπή μόνο στον τράχηλο.
- Στο 20% μπορεί να εμφανισθεί υποτροπή και απομακρυσμένη μετάσταση.
- Το 16% πεθαίνει μετά από 5 χρόνια από την υποτροπή.
- Το 50% των ασθενών μπορεί να μείνουν ελεύθεροι νόσου μετά από μια δεύτερη επέμβαση για υποτροπή.
- Οι ασθενείς με ΜΕΝ3 έχουν την χειρότερη πρόγνωση (35% στα 10 χρόνια).
Συνοψίζοντας πάνω στις επανεγχειρήσεις για υποτροπή του μυελοειδούς καρκίνου στο θυρεοειδή αδένα καταλήγουμε στα εξής: Όταν η κακοήθεια διαγιγνώσκεται μετά την θυρεοειδεκτομή και όταν υπάρχει υποτροπή ή επιμονή της νόσου χρειάζεται συμπληρωματική θεραπεία και επανεγχείρηση
Αμετάπλαστο καρκίνωμα θυρεοειδούς
Tο αμετάπλαστο καρκίνωμα του θυρεοειδούς (Anaplastic Thyroid Cancer / ΑΤC) είναι σπάνιο, και αντιπροσωπεύει μόλις το 1%-2% των κακοηθειών του οργάνου. Αποτελεί την επιθετικότερη μορφή καρκίνου του θυρεοειδούς. Σε αντίθεση με τα καλά διαφοροποιημένα καρκινώματα, το ATC είναι θανατηφόρο και είναι υπεύθυνο για πάνω από τους μισούς θανάτους, που οφείλονται σε κακοήθειες του θυρεοειδούς. Η πρόγνωση είναι απελπιστική και η επιβίωση δεν υπερβαίνει τους λίγους μήνες από την στιγμή της αρχικής διάγνωσης. Αν ο άρρωστος επιζήσει πάνω από ένα χρόνο, πρέπει να επανεξεταστεί η ιστολογική εξέταση μήπως πρόκειται για εσφαλμένη διάγνωση. Υπάρχουν ισχυρές ενδείξεις ότι το αμετάπλαστο καρκίνωμα προέρχεται από ένα καλά διαφοροποιημένου καρκίνου και ιδιαίτερα από το θηλώδες ή το θυλακιώδες. Αυτή η μεταλλαγή συμβαίνει στο 1% των ασθενών με καλά διαφοροποιημένο καρκίνο θυρεοειδούς. Επίσης σε αμετάπλαστα καρκινώματα με μικρά κύτταρα η διάγνωση θα πρέπει να γίνεται με πολύ προσοχή και η διαφοροδιάγνωση περιλαμβάνει το λέμφωμα και το χαμηλής διαφοροποίησης μυελοειδές, διότι η πρόγνωση διαφέρει αισθητά. Συνηθέστερα προσβάλλονται οι γυναίκες και η πλειονότητα των όγκων εμφανίζονται κατά την έβδομη ή όγδοη δεκαετία της ζωής.
Παθολογοανατομία
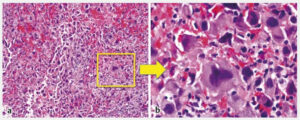 Κατά την μακροσκοπική επισκόπηση οι αναπλαστικοί όγκοι είναι συμπαγείς και υπόλευκοι. Μικροσκοπικά φαίνονται στρώσεις κυττάρων με ατρακτοειδές ή πολυγωνικό σχήμα και μεγάλα πολυπύρηνα γιγαντοκύτταρα με ενδοπυρηνικά κυτταροπλασματικά έγκλειστα. Υπάρχει μια ευρεία ποικιλία των κυτταρικών τύπων, που κυμαίνονται από την μέση διαφοροποίηση έως τα πολύ φτωχά διαφοροποιημένα κύτταρα. Κατά περίπτωση, στοιχεία ή τμήματα από πλακώδη κύτταρα ή νησίδια πιο αναγνωρίσιμων θυρεοειδικών καρκίνων, όπως το θηλώδες καρκίνωμα, μπορούν να αναγνωριστούν σε περιοχές του όγκου. Αυτό έχει οδηγήσει στην εικασία ότι το αμετάπλαστο καρκίνωμα μπορεί να προκύψει από ένα καλά διαφοροποιημένο θηλώδες ή θυλακιώδες καρκίνωμα.
Κατά την μακροσκοπική επισκόπηση οι αναπλαστικοί όγκοι είναι συμπαγείς και υπόλευκοι. Μικροσκοπικά φαίνονται στρώσεις κυττάρων με ατρακτοειδές ή πολυγωνικό σχήμα και μεγάλα πολυπύρηνα γιγαντοκύτταρα με ενδοπυρηνικά κυτταροπλασματικά έγκλειστα. Υπάρχει μια ευρεία ποικιλία των κυτταρικών τύπων, που κυμαίνονται από την μέση διαφοροποίηση έως τα πολύ φτωχά διαφοροποιημένα κύτταρα. Κατά περίπτωση, στοιχεία ή τμήματα από πλακώδη κύτταρα ή νησίδια πιο αναγνωρίσιμων θυρεοειδικών καρκίνων, όπως το θηλώδες καρκίνωμα, μπορούν να αναγνωριστούν σε περιοχές του όγκου. Αυτό έχει οδηγήσει στην εικασία ότι το αμετάπλαστο καρκίνωμα μπορεί να προκύψει από ένα καλά διαφοροποιημένο θηλώδες ή θυλακιώδες καρκίνωμα.
Κλινική εικόνα – Διάγνωση
 Ο ασθενής με ΑΤC φέρει μια σκληρή, ακανόνιστη και καθηλωμένη μάζα στον τράχηλο, η οποία διογκώνεται ταχέως και μπορεί να είναι επώδυνη. Ο όγκος συχνά πιέζει την τραχεία και διηθεί το δέρμα προκαλώντας νέκρωση. Λεμφαδενική διασπορά παρατηρείται στο 84% των ασθενών και μάλιστα σχετικά πρώιμα. Η τοπική επέκταση του όγκου μπορεί να προκαλέσει διήθηση του λάρυγγα, του οισοφάγου, των κύριων νευροαγγειακών δομών και μάλιστα των καρωτίδων. Οι ασθενείς συνηθέστατα έχουν βράγχος φωνής, εξαιτίας πάρεσης των φωνητικών χορδών από διήθηση των λαρυγγικών νεύρων από τον όγκο. Συμπτώματα όπως δυσφαγία, δυσφωνία και δύσπνοια είναι αρκετά συχνά. Η κλινική εικόνα επιδεινώνεται ραγδαία με κατάληξη την έμφραξη της τραχείας και ταχεία διήθηση των γύρω ιστών. Το σύνδρομο της άνω κοίλης φλέβας αποτελεί σύνηθες μέρος της κλινικής εικόνας. Συστηματικές μακρινές μεταστάσεις εντοπίζονται σε ποσοστό 75% στους πνεύμονες, στα οστά, στον εγκέφαλο και στα επινεφρίδια.
Ο ασθενής με ΑΤC φέρει μια σκληρή, ακανόνιστη και καθηλωμένη μάζα στον τράχηλο, η οποία διογκώνεται ταχέως και μπορεί να είναι επώδυνη. Ο όγκος συχνά πιέζει την τραχεία και διηθεί το δέρμα προκαλώντας νέκρωση. Λεμφαδενική διασπορά παρατηρείται στο 84% των ασθενών και μάλιστα σχετικά πρώιμα. Η τοπική επέκταση του όγκου μπορεί να προκαλέσει διήθηση του λάρυγγα, του οισοφάγου, των κύριων νευροαγγειακών δομών και μάλιστα των καρωτίδων. Οι ασθενείς συνηθέστατα έχουν βράγχος φωνής, εξαιτίας πάρεσης των φωνητικών χορδών από διήθηση των λαρυγγικών νεύρων από τον όγκο. Συμπτώματα όπως δυσφαγία, δυσφωνία και δύσπνοια είναι αρκετά συχνά. Η κλινική εικόνα επιδεινώνεται ραγδαία με κατάληξη την έμφραξη της τραχείας και ταχεία διήθηση των γύρω ιστών. Το σύνδρομο της άνω κοίλης φλέβας αποτελεί σύνηθες μέρος της κλινικής εικόνας. Συστηματικές μακρινές μεταστάσεις εντοπίζονται σε ποσοστό 75% στους πνεύμονες, στα οστά, στον εγκέφαλο και στα επινεφρίδια.
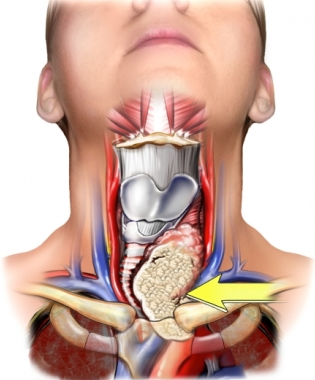 Η διάγνωση του αμετάπλαστου καρκινώματος τεκμηριώνεται με FNAB, η οποία αποκαλύπτει τα παθογνωμονικά γιγάντια και πολυπύρηνα κύτταρα. Περιστασιακά χρειάζεται ανοικτή βιοψία με τομές για να τεκμηριωθεί η διάγνωση και ταυτόχρονα γίνεται και ισθμεκτομή για να αποσοβηθεί η συμπίεση της τραχείας. Η διαφορική διάγνωση γίνεται από το λέμφωμα ή το κακώς διαφοροποιημένο μυελοειδές καρκίνωμα και για το λόγο αυτό ενδέχεται να απαιτηθεί έλεγχος του ανοσοφαινοτύπου καθώς και άλλων μοριακών δεικτών.
Η διάγνωση του αμετάπλαστου καρκινώματος τεκμηριώνεται με FNAB, η οποία αποκαλύπτει τα παθογνωμονικά γιγάντια και πολυπύρηνα κύτταρα. Περιστασιακά χρειάζεται ανοικτή βιοψία με τομές για να τεκμηριωθεί η διάγνωση και ταυτόχρονα γίνεται και ισθμεκτομή για να αποσοβηθεί η συμπίεση της τραχείας. Η διαφορική διάγνωση γίνεται από το λέμφωμα ή το κακώς διαφοροποιημένο μυελοειδές καρκίνωμα και για το λόγο αυτό ενδέχεται να απαιτηθεί έλεγχος του ανοσοφαινοτύπου καθώς και άλλων μοριακών δεικτών.
Θεραπεία – Πρόγνωση
Αυτός ο ταχύτατα αναπτυσσόμενος όγκος είναι μια από τις επιθετικότερες κακοήθειες του θυρεοειδούς, με ορισμένους ασθενείς να επιβιώνουν μόνο 6 μήνες μετά την αρχική διάγνωση. Όλες οι μορφές θεραπείας χαρακτηρίζονται από απογοητευτικά αποτελέσματα.
Ενώ η συνήθης θεραπεία των καρκίνων του θυρεοειδούς είναι η ολική θυρεοειδεκτομή αυτό δεν ισχύει στην περίπτωση του αμετάπλαστου καρκίνου. Η χειρουργική θυρεοειδεκτομή δεν είναι θεραπευτική γιατί πολλοί ασθενείς προσέρχονται με απομακρυσμένες μεταστάσεις και η συνδυασμένη θεραπεία έχει πενιχρά αποτελέσματα. Η εγχείρηση γίνεται περισσότερο για να απαλλάξει τον ασθενή από τα πιεστικά φαινόμενα και όχι για να απομακρύνει τον όγκο, πράγμα που δεν είναι εφικτό. Συχνά χρειάζεται να γίνει τραχειοστομία. Οι μεμονωμένες μακρινές μεταστατικές εναποθέσεις του αδιαφοροποίητου θυρεοειδικού καρκινώματος θα πρέπει να αφαιρούνται χειρουργικά, εφόσον αυτό είναι εφικτό, και συμπληρωματικά χορηγείται ραδιενεργό ιώδιο-131 μετά την ολική θυρεοειδεκτομή.
 Η τοπική υποτροπή μετά την χειρουργική θεραπεία αποτελεί το κανόνα. Φαίνεται ότι, εάν το αμετάπλαστο καρκίνωμα παρουσιαστεί αρχικά με μια εξαιρέσιμη μάζα, μπορεί να υπάρχει κάποια μικρή βελτίωση στην επιβίωση. O συνδυασμός προεγχειρητικής ακτινο-χημειοθεραπείας και επέμβασης, ακολουθούμενος από νέα ακτινο- και χημειοθεραπεία μετεγχειρητικά, παρέχει τα καλύτερα αποτελέσματα. Σε περιπτώσεις προχωρημένης τοπικής νόσου, όπου υπάρχει έντονο ή επαπειλούμενο αναπνευστικό πρόβλημα, πρέπει να αφαιρεθεί όσο το δυνατόν περισσότερη νεοπλασματική μάζα και να γίνει ανακουφιστική τραχειοστομία.
Η τοπική υποτροπή μετά την χειρουργική θεραπεία αποτελεί το κανόνα. Φαίνεται ότι, εάν το αμετάπλαστο καρκίνωμα παρουσιαστεί αρχικά με μια εξαιρέσιμη μάζα, μπορεί να υπάρχει κάποια μικρή βελτίωση στην επιβίωση. O συνδυασμός προεγχειρητικής ακτινο-χημειοθεραπείας και επέμβασης, ακολουθούμενος από νέα ακτινο- και χημειοθεραπεία μετεγχειρητικά, παρέχει τα καλύτερα αποτελέσματα. Σε περιπτώσεις προχωρημένης τοπικής νόσου, όπου υπάρχει έντονο ή επαπειλούμενο αναπνευστικό πρόβλημα, πρέπει να αφαιρεθεί όσο το δυνατόν περισσότερη νεοπλασματική μάζα και να γίνει ανακουφιστική τραχειοστομία.
Στις περισσότερες κλινικές μελέτες που χρησιμοποιήθηκε συνδυασμένη θεραπεία αναφέρεται τοπικός έλεγχος της νόσου σε ποσοστό 22% – 76%. Εντούτοις, η μέση επιβίωση κυμαίνεται μεταξύ 2,5-9 μήνες και η 2ετής επιβίωση είναι χαμηλότερη από 20%. Παράγοντες που ευνοούν την επιβίωση θεωρούνται το νεαρό της ηλικίας (<45 έτη), το θήλυ φύλο, το μέγεθος όγκου <6 cm, η περιορισμένη νόσος στον τράχηλο και η πλήρης χειρουργική αφαίρεση του όγκου. Δυστυχώς, οι θεραπευτικές παρεμβάσεις μέχρι σήμερα έχουν μικρό ρόλο στην αντιμετώπιση του αμετάπλαστου καρκινώματος, γιατί η πλειονότητα των ασθενών καταλήγουν εντός λίγων μηνών από την διάγνωση είτε από τοπική διήθηση είτε από μακρινές μεταστάσεις.
Αμφιλεγόμενα θέματα στην χειρουργική του καρκίνου του θυρεοειδούς
Ο καλά διαφοροποιημένος καρκίνος του θυρεοειδούς αποτελεί την πιο συχνή ενδοκρινική νεοπλασία, σημειώνοντας μάλιστα αυξανόμενη επίπτωση τις τελευταίες δεκαετίες. Καταλαμβάνει την 9η θέση σε σειρά συχνότητας εμφάνισης καρκίνου παγκοσμίως. Η παρατηρούμενη αύξηση αποδίδεται στην θεαματική εξέλιξη των απεικονιστικών μεθόδων, κυρίως του υπερηχογραφήματος και στην επακόλουθη ανίχνευση υποκλινικών μορφών θυρεοειδικού καρκίνου με μοριακές μεθόδους. Τα τελευταία χρόνια παρατηρείται μια στρατηγική αποκλιμάκωσης στην επιθετική αντιμετώπιση του καλά διαφοροποιημένου θυρεοειδικού καρκίνου.
Από την ανασκόπηση της διεθνούς βιβλιογραφίας διαπιστώνονται διφορούμενες απόψεις αναφορικά με την διαχείριση της νόσου. Οι σημαντικότερες από αυτές είναι οι ακόλουθες:
- Οι ενδείξεις για χειρουργική αντιμετώπιση
- Έκταση χειρουργικής επέμβασης
- Ο ρόλος των μοριακών δεικτών
- Κεντρικός λεμφαδενικός καθαρισμός
Οι ενδείξεις για χειρουργική αντιμετώπιση
Η θυρεοειδεκτομή θεωρείται θεραπεία πρώτης επιλογής για την αντιμετώπιση των καλά διαφοροποιημένων καρκινωμάτων του θυρεοειδούς αδένα. Πιστεύεται ότι τα οφέλη της επέμβασης υπεραντισταθμίζουν τον κίνδυνο ενδεχόμενων επιπλοκών για όγκους >1 cm.
Ωστόσο για όγκους μεγέθους <1 cm πολλές κλινικές μελέτες υποστηρίζουν ότι η στενή και επιμελής παρακολούθηση αποτελεί αποδεκτή εναλλακτική. Πρόσφατα, στις οδηγίες της ATA δεν συστήνεται η διενέργεια FNA σε όζους <1 cm, ακόμη κι όταν υπάρχει υποψία κακοήθειας με βάση τα υπερηχογραφικά στοιχεία όπως υποηχογένεια με μικροαποτιτανώσεις, ασαφή όρια, με προϋπόθεση την απουσία εξωθυρεοειδικής επέκτασης και λεμφαδενικών μεταστάσεων.
Οι κατευθυντήριες οδηγίες πολλών επιστημονικών εταιρειών ενδοκρινικής χειρουργικής προτείνουν την ενεργό επιτήρηση ως εναλλακτική θεραπεία για το μονοεστιακό, ενδοθυρεοειδικό μικροκαρκίνωμα (μέγιστο μέγεθος μέχρι 1 cm) που δεν εμφανίζει λεμφαδενικές μεταστάσεις ή επιθετική βιολογική συμπεριφορά. Η πλειονότητα τέτοιων όγκων δεν εξελίσσεται για αρκετό χρονικό διάστημα. Μετά από 10ετή παρακολούθηση, ποσοστό 3,8% από τα μικροθηλώδη καρκινώματα εμφανίζουν πρόοδο της νόσου και λεμφαδενικές μεταστάσεις. Κανένας από αυτούς τους ασθενείς που υποβλήθηκε σε θυρεοειδεκτομή μεταγενέστερα δεν εμφάνισε απειλητική για την ζωή μεταστατική νόσο ή απεβίωσε κατά την επιτήρηση ή μετά την επέμβαση. Σύμφωνα με αυτά τα αποτελέσματα φαίνεται ότι η αναβολή της θυρεοειδεκτομής για το θηλώδες μικροκαρκίνωμα είναι εφικτή μέχρι την εμφάνιση σημείων εξέλιξης της νόσου. Κριτήρια αποκλεισμού για συντηρητική αντιμετώπιση των μονοεστιακών ενδοθυρεοειδικών μικροκαρκινωμάτων του θυρεοειδούς είναι τα ακόλουθα:
- Η νεαρή ηλικία
- Βλάβες που αυξάνονται σε μέγεθος
- Εμφάνιση λεμφαδενικών μεταστάσεων
- Διήθηση της τραχείας και του παλίνδρομου λαρυγγικού νεύρου
- Ιστολογικά ευρήματα υψηλόβαθμης κακοήθειας
- Υπερηχογραφική υποψία λεμφαδενικής διασποράς ή κυτταρολογική απόδειξη μετά από FNA.
Έκταση χειρουργικής επέμβασης
Οι ασθενείς που παρουσιάζουν εξέλιξη της νόσου κατά την ενεργό επιτήρηση και εκείνοι με θηλώδες καρκίνωμα μεγέθους >1cm είναι κατάλληλοι υποψήφιοι για θυρεοειδεκτομή. Η λοβεκτομή με ή χωρίς ισθμεκτομή, ή σχεδόν ολική και η ολική θυρεοειδεκτομή αποτελούν αποδεκτές επιλογές για το χαμηλού κινδύνου θηλώδες καρκίνωμα. Οι προγενέστερες εκδόσεις των οδηγιών της ATA πρότειναν την ολική ή την σχεδόν ολική θυρεοειδεκτομή ως επέμβαση εκλογής, καθώς η λοβεκτομή συνδέεται με μεγαλύτερα ποσοστά υποτροπής και αδυναμία χορήγησης ραδιενεργού ιωδίου μετεγχειρητικά. Είναι αποδεδειγμένο ότι η ολική θυρεοειδεκτομή συνδέεται με καλύτερη 10ετή συνολική επιβίωση όταν εφαρμόζεται σε όγκους >1 cm αλλά και όγκους επιθετικής βιολογικής συμπεριφοράς, όχι όμως σε μικροκαρκίνωμα.
Η ολική όμως θυρεοειδεκτομή σχετίζεται με μεγαλύτερη συχνότητα επιπλοκών και απαιτείται ορμονική θεραπεία υποκατάστασης με λεβοθυροξίνη δια βίου. Πράγματι, η ολική θυρεοειδεκτομή συνδέεται με μεγαλύτερο κίνδυνο υπασβεστιαιμίας, αναπνευστικών επιπλοκών, αιματώματος, αιμορραγίας, κάκωσης του παλίνδρομου λαρυγγικού νεύρου, δυσφωνίας και τραχειοστομίας.
Ωστόσο, συγκρίνοντας την ολική θυρεοειδεκτομή με την λοβεκτομή σε σχέση με την συνολική επιβίωση, η λοβεκτομή αυξάνει την θνητότητα κατά 21% σε ασθενείς με καλά διαφοροποιημένο καρκίνο όλων των μεγεθών. Υψηλότερα ποσοστά υποτροπής παρατηρούνται όταν η λοβεκτομή διενεργείται για όγκους >1 cm. Η εξωθυρεοειδική επέκταση, η παρουσία διηθημένων λεμφαδένων και όγκοι >4 cm σχετίζονται με αυξημένη πιθανότητα υποτροπής.
Σύμφωνα με τις επικαιροποιημένες κατευθυντήριες οδηγίες της ATA, σε ασθενείς με όγκους μεγέθους <4cm και χαρακτηριστικά χαμηλού κινδύνου για υποτροπή, χωρίς ιστορικό ακτινοβόλησης του τραχήλου ή οικογενειακό ιστορικό θυρεοειδικού καρκίνου η διενέργεια λοβεκτομής θεωρείται επαρκής.
Η πλειονότητα των ασθενών (81%) με όγκο χαμηλού κινδύνου για υποτροπή (καλά διαφοροποιημένο θυρεοειδικό καρκίνο), στατιστικώς δεν εμφανίζουν καμία σημαντική διαφορά στην 10ετή παρακολούθηση είτε υποβάλλονται σε λοβεκτομή είτε σε ολική θυρεοειδεκτομή. Η ηλικία του ασθενούς αναγνωρίζεται σπουδαίος προγνωστικός παράγοντας του καλά διαφοροποιημένου καρκίνου. Πράγματι, οι ασθενείς ηλικίας <45 ετών έχουν καλύτερης πρόγνωσης καρκίνους ανεξάρτητα από το μέγεθος του όγκου και της ύπαρξης τραχηλικής μεταστατικής νόσου. Εξαίρεση αποτελούν εκείνοι με απομακρυσμένες μεταστάσεις.
Ο ρόλος των μοριακών δεικτών
Αν και η ανίχνευση μοριακών δεικτών εφαρμόζεται ευρέως στο πλαίσιο της διγνωστικής διερεύνησης των θυρεοειδικών όζων ενδιάμεσης ιστολογίας (Bethesda III), δεν είναι σαφές ακόμη πώς θα μπορούσαν να επηρεάσουν την έκταση της επέμβασης. Σε αρκετές μελέτες, η μετάλλαξη του γονιδίου BRAF VE συνδέεται με αυξημένο κίνδυνο υποτροπής, καθώς και με χαρακτηριστικά όγκου υψηλού κινδύνου, όπως λεμφαδενικές μεταστάσεις, εξωθυρεοειδική επέκταση και απομακρυσμένες μεταστάσεις. Η παρουσία μετάλλαξης του BRAF VE σχετίζεται και με αυξημένη ειδική θνητότητα (DSS), αν και δεν αποτελεί ανεξάρτητο προγνωστικό παράγοντα. Επίσης, το μεταλλαγμένο BRAF συνδέεται ανεξάρτητα με αυξημένο κίνδυνο υποτροπής στα 5 έτη σε όγκους χαμηλού κινδύνου.
Κεντρικός λεμφαδενικός καθαρισμός
Αναφορικά με την χρησιμότητα του κεντρικού λεμφαδενικού καθαρισμού σε ασθενείς με καλά διαφοροποιημένα νεοπλάσματα του θυρεοειδούς αδένα, οι υφιστάμενες μελέτες παρουσιάζουν αντιτιθέμενα αποτελέσματα. Ο προφυλακτικός λεμφαδενικός καθαρισμός συμβάλλει σε 35% ελάττωση της πιθανότητας τοπικο-περιοχικής υποτροπής. Επίσης, ποσοστό 36% των ασθενών που δεν υποβάλλεται σε προφυλακτικό λεμφαδενικό καθαρισμό εμφανίζει εξωθυρεοειδική επέκταση. Στο 50% των ασθενών με προφυλακτικό λεμφαδενικό καθαρισμό ανευρίσκεται μικρομεταστατική νόσος στους περιοχικούς λεμφαδένες. Αυτή η ομάδα υποβάλλεται σε λιγότερες συνεδρίες ραδιενεργού ιωδίου 131 μετεγχειρητικά, αλλά εμφανίζουν υψηλότερα ποσοστά μόνιμου υποπαραθυρεοειδισμού.
Ενώ ο προφυλακτικός λεμφαδενικός καθαρισμός αποκαλύπτει λεμφαδενική διασπορά στο 50% των ασθενών και οριακά ποσοστά μείωσης των υποτροπών, παράλληλα σχετίζεται με αυξημένα ποσοστά μόνιμου υποπαραθυρεοειδισμού και παροδικής πάρεσης του παλίνδρομου λαρυγγικού νεύρου. Εξ αυτού του λόγου πολλοί χειρουργοί πρεσβεύουν ότι ο προφυλακτικός λεμφαδενικός καθαρισμός δεν θα πρέπει να εκτελείται ως ρουτίνα ακόμη και από χειρουργούς με μεγάλο αριθμό θυρεοειδεκτομών.
Σε αντιδιαστολή, μερίδα ειδικών χειρουργών πιστεύουν ότι ο προφυλακτικός λεμφαδενικός καθαρισμός είναι μια ασφαλής και επαρκής επιλογή στην θεραπεία του θηλώδους καρκινώματος, επειδή μειώνει αισθητά το ποσοστό υποτροπών ιδιαίτερα στο κεντρικό τραχηλικό διαμέρισμα.
Με βάση τις οδηγίες της ATA, η διενέργεια προφυλακτικού κεντρικού λεμφαδενικού καθαρισμού συστήνεται για ασθενείς με Τ3/Τ4 όγκους ή αποδεδειγμένη με FNA λεμφαδενική διασπορά. Ο ενδεχόμενος κίνδυνος του μόνιμου ή παροδικού υποπαραθυρεοειδισμού και κάκωσης του παλίνδρομου λαρυγγικού νεύρου πρέπει να σταθμίζονται με το όφελος της επέμβασης. Υπολογίζεται ότι για να ελαττωθεί η πιθανότητα υποτροπής σε ένα ασθενή, θα πρέπει να υποβληθούν σε προφυλακτικό κεντρικό λεμφαδενικό καθαρισμό 31 ασθενείς. Επομένως, η μείωση του κινδύνου υποτροπής δεν είναι εμφανώς διακριτή.
Τελευταία τάση στην χειρουργική του θυρεοειδούς αποτελεί ο ετερόπλευρος, σύστοιχος του όγκου προφυλακτικός λεμφαδενικός καθαρισμός. Έτσι, επιτυγχάνονται μειωμένα ποσοστά υποτροπών και επιπλοκών. Παράλληλα, τα αποτελέσματα της ταχείας βιοψίας του χειρουργικού παρασκευάσματος ενδέχεται να τροποποιήσει την χειρουργική στρατηγική. Η ανίχνευση περισσότερων από πέντε (5) διηθημένων λεμφαδένων αποτελεί ένδειξη για διενέργεια αμφοτερόπλευρου κεντρικού λεμφαδενικού καθαρισμού.
Στην χώρα μας οι περισσότεροι χειρουργοί προτείνουν την διενέργεια λοβεκτομής μόνο για τα καλά διαφοροποιημένα μικροκαρκινώματα και προφυλακτικό λεμφαδενικό καθαρισμό σε ασθενείς με Τ3/Τ4 όγκους ή σε επιβεβαιωμένο με FNA μεταστατικό καρκίνο.
Καρκίνος θυρεοειδή στα παιδιά
 Καρκίνος Θυρεοειδή στα Παιδιά: Ποσοστό 2% των παιδιών του γενικού πληθυσμού ηλικίας 10 – 18 ετών εμφανίζουν ψηλαφητούς όζους στον θυρεοειδή αδένα. Όταν όμως γίνει έλεγχος με τη βοήθεια υπερηχογραφήματος, όζοι θυρεοειδούς ανευρίσκονται σε ποσοστό 5 % των παιδιών.
Καρκίνος Θυρεοειδή στα Παιδιά: Ποσοστό 2% των παιδιών του γενικού πληθυσμού ηλικίας 10 – 18 ετών εμφανίζουν ψηλαφητούς όζους στον θυρεοειδή αδένα. Όταν όμως γίνει έλεγχος με τη βοήθεια υπερηχογραφήματος, όζοι θυρεοειδούς ανευρίσκονται σε ποσοστό 5 % των παιδιών.
Η πλειονότητα των όζων αυτών είναι καλοήθεις (θυλακιώδη αδενώματα, φλεγμονώδης αιτιολογία), ενώ κάποιοι απ’ αυτούς υποκρύπτουν καρκίνο θυρεοειδούς. Η πιθανότητα να υποκρύπτεται καρκίνος σε όζους θυρεοειδούς στα παιδιά είναι μεγαλύτερη σε σύγκριση με τους ενήλικες.
Η συχνότητα του καρκίνου του θυρεοειδούς στα παιδιά βαίνει αυξανόμενη κατά 1 % περίπου ανά έτος στη διάρκεια των τελευταίων 30 ετών. Ο θυρεοειδής αδένας των παιδιών είναι ιδιαίτερα ευπαθής στην ακτινοβολία και στην καρκινογένεση.
Ο καρκίνος θυρεοειδούς στα παιδιά συνήθως παρουσιάζεται υπό τη μορφή προχωρημένης νόσου. Σε σύγκριση με τους ενήλικες, τα παιδιά με καρκίνο θυρεοειδούς έχουν μεγαλύτερη συχνότητα λεμφαδενικών και μακρινών μεταστάσεων κατά την αρχική διάγνωση και υψηλότερη συχνότητα υποτροπής στην πρώτης 10ετίας μετά την επέμβαση.
Θεραπεία
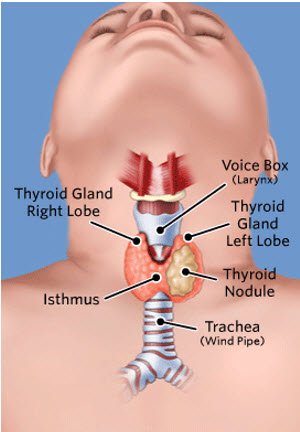 Η ολική ή σχεδόν-ολική θυρεοειδεκτομή είναι η επέμβαση εκλογής (στα παιδιά το θηλώδες καρκίνωμα είναι συχνά πολυεστιακό). Γενικά δεν συνιστάται η εκτέλεση προφυλακτικού λεμφαδενικού καθαρισμού του τραχήλου. Ειδικά στα παιδιά η θυρεοειδεκτομή θα πρέπει να γίνεται από έμπειρο χειρουργό ενδοκρινών αδένων, καθώς η νοσηρότητα είναι μεγαλύτερη σε σχέση με τους ενήλικες (μεγαλύτερη όσο μικρότερη είναι η ηλικία του παιδιού).
Η ολική ή σχεδόν-ολική θυρεοειδεκτομή είναι η επέμβαση εκλογής (στα παιδιά το θηλώδες καρκίνωμα είναι συχνά πολυεστιακό). Γενικά δεν συνιστάται η εκτέλεση προφυλακτικού λεμφαδενικού καθαρισμού του τραχήλου. Ειδικά στα παιδιά η θυρεοειδεκτομή θα πρέπει να γίνεται από έμπειρο χειρουργό ενδοκρινών αδένων, καθώς η νοσηρότητα είναι μεγαλύτερη σε σχέση με τους ενήλικες (μεγαλύτερη όσο μικρότερη είναι η ηλικία του παιδιού).
Η ΑΤΑ (American Thyroid Association) καθόρισε τρεις ομάδες κινδύνου για τα παιδιά με καρκίνο θυρεοειδούς, με βάση συγκεκριμένα χαρακτηριστικά και στοιχεία από τον προεγχειρητικό έλεγχο και τα διεγχειρητικά ευρήματα, με στόχο την αποφυγή της υπερθεραπείας σε παιδιά της ομάδας χαμηλού κινδύνου και της υποθεραπείας σε παιδιά της ομάδας ενδιάμεσου ή υψηλού κινδύνου. Στις ομάδες υψηλού και ενδιάμεσου κινδύνου μετά την επέμβαση να γίνεται έλεγχος με σπινθηρογράφημα με ραδιενεργό ιώδιο και μέτρηση θυρεοσφαιρίνης ορού, με στόχο την ακριβέστερη σταδιοποίηση της νόσου. Εφόσον στο σπινθηρογράφημα βρεθεί αυξημένη καθήλωση του ραδιενεργού ιωδίου εκτός της κοίτης του θυρεοειδούς αδένα θα πρέπει να γίνει περαιτέρω απεικονιστικός έλεγχος, που περιλαμβάνει υπερηχογράφημα, αξονική ή μαγνητική τομογραφία ή και PET–CT scan, προκειμένου να απεικονιστεί η εστία που ευθύνεται για την αυξημένη πρόσληψη (συνηθέστατα λεμφαδένας). Η εκτομή της εστίας αυτής είναι επιθυμητή, αν όμως αυτό δεν είναι εφικτό τότε θα πρέπει να γίνει θεραπεία με ραδιενεργό ιώδιο.
Σε παιδιά που ανήκουν στην ομάδα χαμηλού κινδύνου και με χαμηλά επίπεδα Tg ορού (<2 ng/ml) μετά την επέμβαση δεν απαιτείται περαιτέρω θεραπεία με ραδιενεργό ιώδιο. Αντίθετα, θεραπεία με ραδιενεργό ιώδιο ενδείκνυται στις ομάδες ενδιάμεσου και υψηλού κινδύνου, με στόχο την μείωση της πιθανότητας εμφάνισης τοπικοπεριοχικής υποτροπής της νόσου.
Στα παιδιά με θηλώδες καρκίνωμα θα πρέπει μετεγχειρητικά να χορηγείται θεραπεία καταστολής με στόχο τη διατήρηση της TSH σε χαμηλά επίπεδα. Τα επίπεδα της TSH καθορίζονται από την ομάδα κινδύνου, ήτοι: 0.5 – 1.0 mlU/L για την ομάδα χαμηλού κινδύνου, 0.1 – 0.5mlU/L για την ομάδα ενδιάμεσου κινδύνου και < 0.1 mlU/L για την ομάδα υψηλού κινδύνου.
Η μετεγχειρητική παρακολούθηση στα παιδιά με θηλώδες καρκίνωμα γίνεται όπως και στους ενήλικες με περιοδική μέτρηση της θυρεοσφαιρίνης και περιοδικό υπερηχογράφημα τραχήλου.
Πρόγνωση
Η πρόγνωση των παιδιών με καρκίνο θυρεοειδούς είναι καλύτερη σε σύγκριση με τους ενήλικες, μολονότι στα παιδιά η νόσος διαγιγνώσκεται συχνότερα σε πιο προχωρημένο στάδιο. Αυτό ισχύει και για τα παιδιά με υποτροπή της νόσου. Η λεμφαδενική διασπορά της νόσου δεν φαίνεται να επηρεάζει την επιβίωση, συνδυάζεται όμως με αυξημένη πιθανότητα τοπικοπεριοχικής υποτροπής. Τα ποσοστά υποτροπής ποικίλλουν ευρέως στη βιβλιογραφία, από 10 έως 47 % (στην κοίτη του θυρεοειδούς, στους τραχηλικούς λεμφαδένες ή σε μακρινές εντοπίσεις). Η απώτερη επιβίωση είναι εξαιρετική (99.4% στα 13.5 χρόνια), ενώ άλλοι συγγραφείς αναφέρουν επιβίωση της τάξης του 98 % για διάρκεια παρακολούθησης από 12 έως 40 χρόνια. Τα ποσοστά απώτερης επιβίωσης των παιδιών με θηλώδες καρκίνωμα θυρεοειδούς είναι εξαιρετικά (επιβίωση στα 5, 15 και 30 χρόνια 98 %, 97 % και 91 %). Ανάλογα είναι και τα ποσοστά επιβίωσης για το θυλακιώδες καρκίνωμα του θυρεοειδούς (96 %, 95 % και 92 %, αντίστοιχα). Αντίθετα, η επιβίωση είναι χειρότερη για τα παιδιά με μυελοειδές καρκίνωμα θυρεοειδούς (95 %, 86 % και 15 %).
Τα προαναφερόμενα στοιχεία υπογραμμίζουν την αναγκαιότητα αποφυγής ιατρογενών επιπλοκών κατά την αντιμετώπιση του καρκίνου του θυρεοειδούς στα παιδιά. Ειδικά στα παιδιά η επέμβαση θα πρέπει να γίνεται από χειρουργό με εμπειρία στην χειρουργική του θυρεοειδούς, καθώς η νοσηρότητα της επέμβασης είναι μεγαλύτερη σε σχέση με τους ενήλικες και αυξάνεται όσο μειώνεται η ηλικία του παιδιού.
Καρκίνος θυρεοειδούς στην εγκυμοσύνη
 Η καταιγιστική πρόοδος των διαγνωστικών εξετάσεων, η υψηλή κλινική υποψία στις ηλικιακές ομάδες-στόχους αλλά και η αναγνώριση παραγόντων που σχετίζονται με την ασθένεια, οδήγησαν στην διάγνωση όλο και περισσότερων περιστατικών καρκίνου του θυρεοειδούς και μάλιστα σε γυναίκες αναπαραγωγικής ηλικίας. Έτσι, πολλές γυναίκες έρχονται αντιμέτωπες με την νόσο κατά την διάρκεια της εγκυμοσύνης. Το σύνθετο αυτό ιατροκοινωνικό πρόβλημα απαιτεί ορθολογισμό, στάθμιση κινδύνου και οφέλους, καθώς και πολύπλευρη επιστημονική καθοδήγηση βασισμένη σε αποδείξεις. Καρκίνος του θυρεοειδούς αδένα που σχετίζεται με την εγκυμοσύνη ορίζεται το καρκίνωμα που διαγιγνώσκεται κατά την διάρκεια της εγκυμοσύνης έως και τους πρώτους 12 μήνες μετά τον τοκετό.
Η καταιγιστική πρόοδος των διαγνωστικών εξετάσεων, η υψηλή κλινική υποψία στις ηλικιακές ομάδες-στόχους αλλά και η αναγνώριση παραγόντων που σχετίζονται με την ασθένεια, οδήγησαν στην διάγνωση όλο και περισσότερων περιστατικών καρκίνου του θυρεοειδούς και μάλιστα σε γυναίκες αναπαραγωγικής ηλικίας. Έτσι, πολλές γυναίκες έρχονται αντιμέτωπες με την νόσο κατά την διάρκεια της εγκυμοσύνης. Το σύνθετο αυτό ιατροκοινωνικό πρόβλημα απαιτεί ορθολογισμό, στάθμιση κινδύνου και οφέλους, καθώς και πολύπλευρη επιστημονική καθοδήγηση βασισμένη σε αποδείξεις. Καρκίνος του θυρεοειδούς αδένα που σχετίζεται με την εγκυμοσύνη ορίζεται το καρκίνωμα που διαγιγνώσκεται κατά την διάρκεια της εγκυμοσύνης έως και τους πρώτους 12 μήνες μετά τον τοκετό.
Διαφοροποιημένο καρκίνωμα θυρεοειδούς. Ο συχνότερος τύπος θυρεοειδικού καρκίνου που διαγιγνώσκεται κατά την κύηση είναι το θηλώδες καρκίνωμα. Ποσοστό 95% αυτών των καρκινωμάτων είναι σταδίου Ι και η πλειονότητα διαγιγνώσκεται κατά τα αρχικά στάδια της κύησης. Ο τύπος αυτός παρουσιάζει αργή εξέλιξη και μεθίσταται αργοπορημένα, κυρίως μέσω των λεμφαγγείων. Σε αντιδιαστολή, ο άλλος τύπος διαφοροποιημένου καρκίνου του θυρεοειδούς, το θυλακιώδες (FTC), παρουσιάζει μεγαλύτερη συχνότητα μεταστάσεων και μάλιστα αιματογενώς.
Το ερώτημα είναι κατά πόσο η εγκυμοσύνη επιδεινώνει την πρόγνωση ή ακόμη προκαλεί υποτροπή σε προηγουμένως θεραπευθείσες περιπτώσεις. Φαίνεται πως η κύηση δεν επηρεάζει την συνολική επιβίωση των ασθενών ούτε αυξάνει την θνητότητα ή τις υποτροπές. Ενδέχεται να παρατηρηθεί μικρή αύξηση του μεγέθους των μικροθηλωδών καρκινωμάτων (μέγιστη διάμετρος 1 cm) κατά την εγκυμοσύνη. Στις περιπτώσεις αυτές συστήνεται συχνή παρακολούθηση με υπερηχογράφημα, ιδανικά κάθε τρίμηνο.
Γενικά, παρά το γεγονός ότι ορισμένοι παράγοντες σχετιζόμενοι με την κύηση μπορεί δυνητικά να επιταχύνουν την εξέλιξη της νόσου (π.χ. HCG), στην πράξη η επίδραση της εγκυμοσύνης συνολικά είναι ελάχιστη έως αμελητέα. Με άλλα λόγια η συχνότητα υποτροπών και τα μεσοδιαστήματα ελεύθερα νόσου είναι συγκρίσιμα με ασθενείς αντίστοιχων ηλικιακών ομάδων που δεν κυοφορούν, ενώ δεν έχουν αναφερθεί περιπτώσεις μετάστασης διαφοροποιημένου καρκινώματος στον πλακούντα ή στο έμβρυο.
Αδιαφοροποίητο καρκίνωμα θυρεοειδή. Η επίδραση της κύησης στο μυελοειδές ή αναπλαστικό καρκίνωμα δεν έχει μελετηθεί επαρκώς, λόγω της πολύ μικρής επίπτωσης της νόσου στην κύηση. Οι κατευθυντήριες οδηγίες υποστηρίζουν την αναγκαιότητα της χειρουργικής θεραπείας κατά το δεύτερο τρίμηνο της κύησης, καθότι η καθυστέρηση κάνει την πρόγνωση εξαιρετικά δυσμενή σε αυτές τις επιθετικές μορφές καρκίνου. Ειδικότερα, σε μικρό μυελοειδές καρκίνωμα με χαμηλή καλσιτονίνη ορού προτείνεται απλή παρακολούθηση μέχρι την ολοκλήρωση της κύησης. Μεγαλύτερου μεγέθους όγκοι με υψηλότερες τιμές καλσιτονίνης είναι κατάλληλοι υποψήφιοι για χειρουργική θεραπεία το συντομότερο. Η πρακτική που ακολουθείται είναι ολική θυρεοειδεκτομή με κεντρικό και πλάγιο λεμφαδενικό καθαρισμό. Στις περιπτώσεις αυτές, όπως και στους επιθετικούς τύπους του καλά διαφοροποιημένου καρκινώματος, η αναβολή της θεραπείας μειώνει δραματικά τις πιθανότητες επιτυχούς αντιμετώπισης της νόσου.
Η διαχείριση ενός τόσο σύνθετου κλινικού προβλήματος απαιτεί διεπιστημονική προσέγγιση, εμπειρία και συμμετοχή πολλών ιατρικών ειδικοτήτων στην θεραπευτική ομάδα, με σκοπό να ελεγχθεί και να αντιμετωπιστεί με ασφάλεια η νόσος και να αποφευχθούν οι επιπλοκές στην μητέρα και το έμβρυο.
Επιδημιολογία και παράγοντες κινδύνου
Ο καρκίνος του θυρεοειδούς είναι μία νόσος με αυξανόμενη επίπτωση σε πλανητικό επίπεδο, καθόσον αφορά όλα τα έθνη και ηλικιακές ομάδες, με ιδιαίτερη προτίμηση στις γυναίκες ηλικίας < 45 ετών, οι οποίες συγκροτούν το 36% των περιπτώσεων θυρεοειδικού καρκίνου. Σε σχέση με τους άντρες, οι γυναίκες νοσούν τρεις φορές συχνότερα. Η αύξηση αυτή παρουσιάζεται εντονότερα στην ανατολική Ευρώπη, πιθανά λόγω μεγαλύτερης έκθεσης χωρών όπως η Λευκορωσία και η Ουκρανία σε ιονίζουσα ακτινοβολία, συνέπεια του ατυχήματος του πυρηνικού αντιδραστήρα στο Chernobyl. Ωστόσο η αυξημένη επίπτωση δεν συνοδεύεται από ανάλογη αύξηση της θνητότητας. Αυτό εξηγείται εν μέρει από την αργή φυσική εξέλιξη της νόσου. Ορισμένοι συγγραφείς αποδίδουν την αυξημένη επίπτωση στην υπερδιάγνωση εξαιτίας πιο ευαίσθητων απεικονιστικών εργαλείων (π.χ. υπέρηχοι), που έχει ως αποτέλεσμα την ανάδειξη βλαβών, που σε άλλη περίπτωση θα έμεναν απαρατήρητες. Αυτό εξηγεί την αυξημένη διάγνωση μικρών όγκων, ενώ η μεγαλύτερη επίπτωση των μεγάλων όγκων αλλά και η αύξηση του θηλώδους καρκινώματος υποδεικνύουν ότι τελικά δεν πρόκειται μόνο για υπερδιάγνωση αλλά για μια πραγματική αύξηση της επίπτωσης της νόσου παγκοσμίως.
Ο καρκίνος του θυρεοειδούς είναι η δεύτερη συχνότερη κακοήθεια στην εγκυμοσύνη, μετά τον καρκίνο του μαστού και αφορά 14 στις 100.000 εγκυμοσύνες. Ποσοστό 10% των περιπτώσεων καρκίνου του θυρεοειδούς σε γυναίκες αναπαραγωγικής ηλικίας διαγιγνώσκονται κατά την εγκυμοσύνη ή τον πρώτο καιρό μετά τον τοκετό και συγκεκριμένα οι 3 από τις 4 αυτές περιπτώσεις εμφανίζονται τους πρώτους 12 μήνες μετά την ολοκλήρωση της κύησης. Παράγοντες κινδύνου αποτελούν η έκθεση σε ιονίζουσα ακτινοβολία, η ιωδοπενία, γενετικά σύνδρομα όπως το MEN-2/3 (1-2% όλων των ασθενών με καρκίνο θυρεοειδούς), καθώς και οι ορμόνες του φύλου, εφόσον η αυξημένη κατά τρεις φορές συχνότητα του καλά διαφοροποιημένου καρκινώματος παρατηρείται σε γυναίκες αναπαραγωγικής ηλικίας. Γενικά το καλά διαφοροποιημένο καρκίνωμα σε νεαρές ασθενείς έχει άριστη πρόγνωση και η επιβίωση δεν διαφέρει ουσιαστικά από τις αντίστοιχες ηλικιακά ασθενείς που διαγνώστηκαν χωρίς να κυοφορούν. Αρκετές μελέτες υποδεικνύουν μια ισχνή σχέση του καρκίνου του θυρεοειδούς με παράγοντες σχετιζόμενους με την αναπαραγωγή και εμμηνορρυσία, όπως ηλικία εμμηναρχής, ηλικία πρώτης κύησης και εμμηνόπαυσης. Μεγάλη ηλικία εμμηναρχής και παρατεταμένη διάρκεια κύκλων εμμηνορρυσίας φαίνονται να αυξάνουν τον κίνδυνο για θηλώδες καρκίνωμα. Η παρατήρηση αυτή δεν επιβεβαιώνεται από άλλες μελέτες. Παρ’ όλα αυτά, η πρόσφατη εγκυμοσύνη (εντός 5 ετών από την ένταξη στην μελέτη) και ο αριθμός των κυήσεων (πάνω από τρεις) φαίνονται να έχουν κάποιο ρόλο.
Θυρεοειδής αδένας και εγκυμοσύνη
Στην περίοδο της εγκυμοσύνης ο θυρεοειδής αδένας αυξάνει σε μέγεθος από 10% σε συνθήκες επάρκειας ιωδίου έως 35% σε συνθήκες σχετικής έλλειψης, στο πρώτο καθώς και στο τελευταίο τρίμηνο της εγκυμοσύνης. Αυξάνονται επίσης οι ημερήσιες ανάγκες σε ιώδιο και η παραγωγή θυρεοειδικών ορμονών περίπου κατά 50%. Η TSH επίσης παρουσιάζει διακυμάνσεις, με μείωση στο πρώτο τρίμηνο και επάνοδο των τιμών στα φυσιολογικά επίπεδα μεταγενέστερα. Οι θυρεοειδικές ορμόνες που προέρχονται από την μητέρα είναι η μοναδική πηγή για το έμβρυο μέχρι και την 12η εβδομάδα κύησης, καθόσον ο εμβρυικός θυρεοειδής αδυνατεί να συγκεντρώσει ιώδιο μέχρι εκείνη την χρονική στιγμή. Σπουδαίο ρόλο στην θυρεοειδική λειτουργία παίζει επίσης η β-χοριακή γοναδοτροπίνη (β-hCG), επειδή η δομική της συγγένεια με την TSH οδηγεί στην ενεργοποίηση των υποδοχέων TSH που φυσιολογικά εκφράζονται στα θυρεοειδικά κύτταρα. Αυτό έχει ως αποτέλεσμα αύξηση της δραστηριότητας του αδένα και μείωση των επιπέδων της TSH ως την 12η εβδομάδα κύησης. Στον ίδιο λόγο αποδίδεται και η αύξηση του μεγέθους και της διασποράς του όγκου στην περίπτωση θηλώδους καρκινώματος. Τέλος, τα οιστρογόνα επάγουν την μειωμένη έκφραση του γονιδίου του συν-μεταφορέα νατρίου – ιωδίου και αύξηση στην θυρεοσφαιρίνη (HTG) του ορού μέσω αύξησης της έκφρασης του γονιδίου της HTG που οφείλεται στην ενεργοποίηση των οιστρογονικών υποδοχέων, οι οποίοι φυσιολογικά εκφράζονται στα θυρεοειδικά κύτταρα.
Χειρουργική θεραπεία
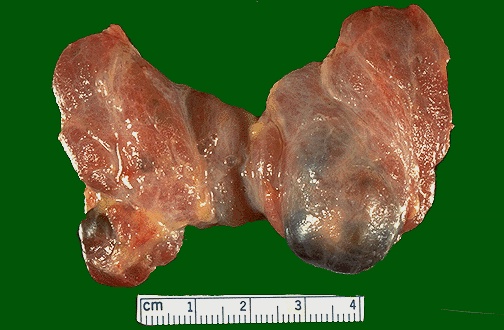 Υπό φυσιολογικές συνθήκες η βασική θεραπεία του θυρεοειδικού καρκίνου είναι η ολική θυρεοειδεκτομή. Κατά την εγκυμοσύνη, όμως, θα πρέπει να ληφθούν υπόψη παράγοντες που αφορούν τόσο την μητέρα όσο και το έμβρυο, παρόλο που γενικά δεν συστήνεται η διακοπή της κύησης σε εγκυμονούσες με καλά διαφοροποιημένο καρκίνο (θηλώδες, θυλακιώδες καρκίνωμα).
Υπό φυσιολογικές συνθήκες η βασική θεραπεία του θυρεοειδικού καρκίνου είναι η ολική θυρεοειδεκτομή. Κατά την εγκυμοσύνη, όμως, θα πρέπει να ληφθούν υπόψη παράγοντες που αφορούν τόσο την μητέρα όσο και το έμβρυο, παρόλο που γενικά δεν συστήνεται η διακοπή της κύησης σε εγκυμονούσες με καλά διαφοροποιημένο καρκίνο (θηλώδες, θυλακιώδες καρκίνωμα).
Σε γυναίκες με καλά διαφοροποιημένο καρκίνωμα χωρίς ενδείξεις προχωρημένης ή επιθετικής νόσου, η χειρουργική θεραπεία προτείνεται να διενεργείται μετά τον τοκετό λόγω της βραδείας εξέλιξης της νόσου. Σε επιθετικές όμως μορφές καλά διαφοροποιημένου καρκινώματος και στο μυελοειδές ή αναπλαστικό καρκίνωμα, προτείνεται η ολική θυρεοειδεκτομή, η οποία μπορεί να γίνει με ασφάλεια στο δεύτερο τρίμηνο της κύησης. Θεραπεία με ραδιενεργό ιώδιο επιτρέπεται μόνο μετά τον τοκετό και την λήξη ή την διακοπή του θηλασμού. Έτσι λοιπόν στις μη επιθετικές μορφές των καλά διαφοροποιημένων καρκίνων που αποτελούν και την πλειονότητα, η αναβολή του χειρουργείου έως την περάτωση της κυοφορίας δεν επηρεάζει την εξέλιξη της νόσου, την πρόγνωση, την θνητότητα ή την αποτελεσματικότητα της μετέπειτα θεραπείας. Αντιθέτως αποφεύγονται μετεγχειρητικές επιπλοκές που κατά την διάρκεια της εγκυμοσύνης μπορεί να αποβούν επιζήμιες, τόσο στην μητέρα όσο και στο έμβρυο.
Ωστόσο, σε κάποιες περιπτώσεις επιθετικής συμπεριφοράς των όγκων που διαγιγνώσκονται κατά τα αρχικά στάδια της εγκυμοσύνης (τοποπεριοχική επέκταση, μεταστατικοί τραχηλικοί λεμφαδένες, πιεστικά φαινόμενα και αύξηση βλάβης >50% σε όγκο ή >20% σε διάμετρο σε 2 διαστάσεις, προχωρημένο στάδιο πριν την 24η-26η εβδομάδα κύησης) επιχειρείται η χειρουργική θεραπεία κατά την διάρκεια του δεύτερου τριμήνου της κύησης. Αυτή η πρακτική θεωρείται ασφαλής, χωρίς αυξημένη μητρική ή εμβρυική θνητότητα.
Μερικοί συγγραφείς αναφέρουν αυξημένη συχνότητα μετεγχειρητικών επιπλοκών στις εγκυμονούσες σε σύγκριση με τις μη κυοφορούσες γυναίκες που χειρουργούνται για καρκίνο θυρεοειδούς. Τέτοιες επιπλοκές περιλαμβάνουν τον μητρικό υποπαραθυρεοειδισμό, την υπασβεστιαιμία, την τετανία, την κάκωση του παλίνδρομου λαρυγγικού νεύρου, την αυξημένη ενδονοσοκομειακή θνητότητα, την παρατεταμένη νοσηλεία και τον αυξημένο κόστος περίθαλψης.
Κατά το πρώτο τρίμηνο της εγκυμοσύνης που λαμβάνει χώρα η οργανογένεση, τα διάφορα φάρμακα που χρησιμοποιούνται στην γενική αναισθησία έχουν τερατογόνες δράσεις ή προκαλούν αποβολή του κυήματος. Η αναβολή του χειρουργείου κατά 6 ως 7 μήνες δεν επηρεάζει δυσμενώς την πρόγνωση. Για τις εγκυμονούσες που διαγιγνώσκονται με την νόσο στο τελευταίο τρίμηνο της κυοφορίας, συστήνεται η αναβολή του χειρουργείου, μέχρι να ολοκληρωθεί ο τοκετός. Με αυτή την πρακτική αποφεύγονται επιπλοκές όπως ταχυκαρδία, πρόωρος τοκετός και υπόταση λόγω πίεσης των μεγάλων αγγειακών δομών από την ευμεγέθη μήτρα, κάτι το οποίο μπορεί να οδηγήσει σε υποάρδευση στο κύημα.
Ραδιενεργό ιώδιο 131
Οι ασθενείς με καλά διαφοροποιημένο καρκίνο του θυρεοειδούς που υποβλήθηκαν σε ολική θυρεοειδεκτομή ακολουθούν επικουρική θεραπεία με ραδιενεργό I131, με σκοπό να καταστραφεί ο υπολειμματικός θυρεοειδικός ιστός ώστε να μειωθεί η πιθανότητα υποτροπής και μελλοντικών μεταστάσεων. Σε κάθε γυναίκα υποψήφια για θεραπεία με ραδιενεργό ιώδιο πρέπει να αποκλεισθεί το ενδεχόμενο της εγκυμοσύνης, καθόσον το ραδιενεργό ιώδιο διαπερνά τον πλακούντα και συσσωρεύεται στον εμβρυικό θυρεοειδή αν δοθεί πριν από την 12η – 13η εβδομάδα κύησης, προκαλώντας υποθυρεοειδισμό. Έτσι, η κύηση αποτελεί απόλυτη αντένδειξη της θεραπείας με ραδιενεργό ιώδιο και γι’ αυτό επιτρέπεται η χορήγηση μόνο μετά τον τοκετό και την λήξη ή διακοπή του θηλασμού. Επίσης, συστήνεται η διακοπή του θηλασμού τουλάχιστον 6 εβδομάδες πριν από την θεραπεία και γενικότερα η αποφυγή εγκυμοσύνης για τουλάχιστον 6 – 12 μήνες μετά την θεραπεία με ραδιενεργό ιώδιο.
Έως τώρα δεν υπάρχουν αποδείξεις ότι η έκθεση στην ακτινοβολία από ραδιενεργό ιώδιο μπορεί να επηρεάσει μελλοντικές προσπάθειες για τεκνοποίηση ή να οδηγήσει σε υπογονιμότητα.
Θεραπεία υποκατάστασης με θυροξίνη
 Η λεβοθυροξίνη χορηγείται στις ακόλουθες περιπτώσεις: α) ως θεραπεία ορμονικής υποκατάστασης της θυρεοειδικής λειτουργίας μετά από ολική θυρεοειδεκτομή, β) ως θεραπεία καταστολής της ΤSHσε υπολειπόμενη καρκινική νόσο και γ) ως θεραπεία καταστολής στις ασθενείς που επιθυμούν αναβολή του χειρουργείου ως το δεύτερο τρίμηνο της κύησης ή ως το πέρας του τοκετού. Εάν πρόκειται για καλά διαφοροποιημένο καρκίνωμα και το χειρουργείο προγραμματίζεται μετά την ολοκλήρωση της κύησης, η λεβοθυροξίνη χορηγείται ως θεραπεία καταστολής με αρχική δόση 50-75 μg ημερησίως και στόχο επίπεδα TSH <0,1-1 mU/l, ενώ τα επίπεδα της TSH και της T4 θα παρακολουθούνται μηνιαία μέχρι την 16η – 20ή εβδομάδα και στην συνέχεια τουλάχιστον μία φορά μεταξύ 26ης και 32ης εβδομάδας κύησης, ώστε να προληφθεί η πιθανότητα για ανεξέλεγκτο υπερ- ή υποθυρεοειδισμό. Το επίπεδο καταστολής θα πρέπει να είναι όμοιο με αυτό εκτός εγκυμοσύνης, μιας και τα διαθέσιμα στοιχεία δείχνουν ότι δεν υπάρχουν ανεπιθύμητες δράσεις στο έμβρυο ή στην μητέρα που να οφείλονται στον υποκλινικό υπερθυρεοειδισμό. Εάν οι απαιτήσεις της νόσου ή της ασθενούς οδηγήσουν σε χειρουργική θεραπεία κατά την πορεία της εγκυμοσύνης, τότε η θεραπεία με λεβοθυροξίνη πρέπει να ξεκινήσει αμέσως μετά την επέμβαση, και αυτό γιατί ο υποθυρεοειδισμός στο έμβρυο ως συνέπεια της μητρικής ανεπάρκειας δυνητικά βλάπτει την νοητική ανάπτυξη του εμβρύου, αλλά και αυξάνει τις πιθανότητες υποτροπής της νόσου στην μητέρα.
Η λεβοθυροξίνη χορηγείται στις ακόλουθες περιπτώσεις: α) ως θεραπεία ορμονικής υποκατάστασης της θυρεοειδικής λειτουργίας μετά από ολική θυρεοειδεκτομή, β) ως θεραπεία καταστολής της ΤSHσε υπολειπόμενη καρκινική νόσο και γ) ως θεραπεία καταστολής στις ασθενείς που επιθυμούν αναβολή του χειρουργείου ως το δεύτερο τρίμηνο της κύησης ή ως το πέρας του τοκετού. Εάν πρόκειται για καλά διαφοροποιημένο καρκίνωμα και το χειρουργείο προγραμματίζεται μετά την ολοκλήρωση της κύησης, η λεβοθυροξίνη χορηγείται ως θεραπεία καταστολής με αρχική δόση 50-75 μg ημερησίως και στόχο επίπεδα TSH <0,1-1 mU/l, ενώ τα επίπεδα της TSH και της T4 θα παρακολουθούνται μηνιαία μέχρι την 16η – 20ή εβδομάδα και στην συνέχεια τουλάχιστον μία φορά μεταξύ 26ης και 32ης εβδομάδας κύησης, ώστε να προληφθεί η πιθανότητα για ανεξέλεγκτο υπερ- ή υποθυρεοειδισμό. Το επίπεδο καταστολής θα πρέπει να είναι όμοιο με αυτό εκτός εγκυμοσύνης, μιας και τα διαθέσιμα στοιχεία δείχνουν ότι δεν υπάρχουν ανεπιθύμητες δράσεις στο έμβρυο ή στην μητέρα που να οφείλονται στον υποκλινικό υπερθυρεοειδισμό. Εάν οι απαιτήσεις της νόσου ή της ασθενούς οδηγήσουν σε χειρουργική θεραπεία κατά την πορεία της εγκυμοσύνης, τότε η θεραπεία με λεβοθυροξίνη πρέπει να ξεκινήσει αμέσως μετά την επέμβαση, και αυτό γιατί ο υποθυρεοειδισμός στο έμβρυο ως συνέπεια της μητρικής ανεπάρκειας δυνητικά βλάπτει την νοητική ανάπτυξη του εμβρύου, αλλά και αυξάνει τις πιθανότητες υποτροπής της νόσου στην μητέρα.
Σε γυναίκες που έχουν λάβει θεραπεία για καλά διαφοροποιημένο καρκίνωμα και στην συνέχεια διάγουν εγκυμοσύνη, οι τιμές της TSH θα προσαρμοστούν ανάλογα με τον κίνδυνο για υποτροπή και την ανταπόκριση στην θεραπεία. Στα άτομα ενδιάμεσου ή υψηλού κινδύνου η TSH θα πρέπει να κατασταλεί και να παραμείνει κάτω από τα φυσιολογικά όρια. Γενικά η χορήγηση του φαρμάκου δεν γίνεται μόνο για λόγους καταστολής ή υποκατάστασης, αλλά και για να επικουρήσει τις αυξημένες κατά 20-30% ανάγκες σε θυρεοειδικές ορμόνες κατά την εγκυμοσύνη, όπως επίσης και σε ασθενείς που είχαν προηγουμένως υποβληθεί σε θυρεοειδεκτομή. Επομένως, κάτι τέτοιο πρέπει επίσης να λαμβάνεται υπόψη στον υπολογισμό της σωστής δοσολογίας, ανάλογα με την εβδομάδα κύησης. Επιπλέον, η νηστεία και η μειωμένη εντερική απορρόφηση εξαιτίας διατροφικών σκευασμάτων που χρησιμοποιούνται ευρέως στην εγκυμοσύνη, όπως ασβέστιο, σίδηρος κ.ά. επηρεάζουν την απορρόφηση της λεβοθυροξίνης, οπότε η δόση και τα μεσοδιαστήματα στην χορήγηση του κάθε φαρμάκου προσαρμόζονται αναλόγως, ενώ χρήσιμη είναι η παρακολούθηση των επιπέδων της TSH και της fT4 ανά 6-8 εβδομάδες στην κύηση και το θηλασμό, για να εξασφαλιστούν επαρκή επίπεδα ορμονών.
Νεότερες θεραπείες
Σε ασθενείς με ανθεκτικό προχωρημένο ή μεταστατικό καλά διαφοροποιημένο καρκίνωμα μετά την θεραπεία με ραδιενεργό ιώδιο μπορούν να χρησιμοποιηθούν νεότεροι φαρμακευτικοί παράγοντες της κατηγορίας των αναστολέων τυροσινικής κινάσης (Tyrosine Kinase Inhibitors-TKI). Τέτοιες ουσίες είναι τα motesanib diphosphate, axitinib, sorafenib, sunitinib, pazopanib1. Έγκριση έχουν λάβει τα σκευάσματα sorafenib, lenvatinib και cabozantinib. Η ασφάλεια των συγκεκριμένων σκευασμάτων για την εγκυμοσύνη και το θηλασμό έχει μελετηθεί προς το παρόν μόνο σε πειραματόζωα και όχι σε ανθρώπους. Στα πειραματόζωα και οι τρεις ουσίες οδήγησαν σε τερατογένεση και τοξικότητα ακόμη και σε μικρότερες από τις συνιστώμενες για ανθρώπινη χρήση δόσεις. Επομένως η τρέχουσα οδηγία είναι γενικά οι ουσίες αυτές να αποφεύγονται κατά την κύηση ή τουλάχιστον η χορήγηση να γίνεται με σύνεση, όπου αυτό κρίνεται απόλυτα αναγκαίο. Πιο συγκεκριμένα, προτείνεται αντισύλληψη κατά την λήψη lenvatinib και αποφυγή κύησης κατά την λήψη sorafenib. Για μυελοειδές καρκίνωμα αποτελεσματικά φαίνονται τα vandetanib, cabozantinib και lenvatinib, με παρόμοιους προβληματισμούς γύρω από την χρήση τους κατά την περίοδο της κύησης. Σε ό,τι αφορά την χημειοθεραπεία με ένα ή περισσότερους φαρμακευτικούς παράγοντες, τα αποτελέσματα δεν φαίνονται ιδιαίτερα ενθαρρυντικά, επομένως η πρακτική αυτή δεν αποτελεί μέρος των θεραπευτικών επιλογών.
Εγκυμοσύνη μετά την θεραπεία θυρεοειδικού καρκινώματος
Σε γυναίκες με ιστορικό θεραπευμένου διαφοροποιημένου καρκινώματος του θυρεοειδούς, φαίνεται ότι η εγκυμοσύνη δεν επηρεάζει την πρόγνωση, την υποτροπή, την δημιουργία λεμφαδενοπάθειας ή την αλλαγή σταδίου της νόσου. Η κύηση δεν επηρεάζει την έκβαση στο θηλώδες καρκίνωμα στις γυναίκες που δεν παρουσίαζαν δομική ή βιοχημική ένδειξη εμμένουσας νόσου κατά την σύλληψη. Αντίθετα, στις γυναίκες με υπολειμματικό νεοπλασματικό ιστό ή υποτροπή της νόσου η κύηση μπορεί να επιδεινώσει την εξέλιξή της.
Φαίνεται ότι η κύηση δεν επιταχύνει ιδιαίτερα την πορεία της νόσου σε γυναίκες με καλά διαφοροποιημένο καρκίνο που έλαβαν θεραπεία και στην συνέχεια τεκνοποίησαν, ενώ δεν σημειώθηκε αυξημένη συχνότητα υποτροπών στις γυναίκες με κατεσταλμένα επίπεδα θυρεοσφαιρίνης (<0,9-2 ng/ml) και αρνητικό υπερηχογραφικό έλεγχο πριν την σύλληψη. Ο πιο ευαίσθητος δείκτης υποτροπής ή υπολειπόμενης νόσου είναι η θυρεοσφαιρίνη ορού (TG). Τιμές <2 ng/dl γενικά αποκλείουν το ενδεχόμενο υπολειμματικού καρκινικού ιστού. Αντίθετα τιμές >2 ng/ml ή τιμές με προοδευτικά αυξανόμενη τάση συνηγορούν για υποτροπή της νόσου.
Επισημαίνεται ότι 20% των ασθενών θα εμφανίσουν αντισώματα έναντι της TG (TG-Ab), τα οποία παρεμβαίνουν στον ορθό υπολογισμό των τιμών. Γι’ αυτό, πριν από οποιαδήποτε μέτρηση TG θα πρέπει να αναζητείται η ύπαρξη TG-Abs, ώστε να αξιολογηθούν ορθά οι τιμές. Αυξανόμενος τίτλος των TG-Abs υποδηλώνει πιθανή υποτροπή της νόσου.
Μετά την θεραπεία με ραδιενεργό ιώδιο συστήνεται αποφυγή εγκυμοσύνης για 6-12 μήνες για να αποφευχθούν οι βλαπτικές επιδράσεις της ακτινοβολίας, η πιθανότητα αποβολής ή πρόωρου τοκετού, αλλά και να εξασφαλιστεί η ύφεση της νόσου. Μια αύξηση στην συχνότητα αυτόματων αποβολών έχει παρατηρηθεί στο άμεσο διάστημα μετά την θεραπεία με ραδιενεργό ιώδιο, αλλά δεν είναι βέβαιο εάν αυτό οφείλεται αποκλειστικά στην θεραπεία αυτή καθαυτή ή στην αυτοανοσία που επάγεται από την νόσο ή ακόμη στην υποθυρεοειδική υπερπρολακτιναιμία που έπεται της θεραπείας.
Υπερηχογραφικός έλεγχος ανά τρίμηνο και μετρήσεις της TG απαιτούνται μόνο σε όσες από τις εγκύους ασθενείς θεραπεύτηκαν από καλά διαφοροποιημένο καρκίνωμα πριν από την κύηση και εμφάνισαν σημεία υποτροπής (π.χ. υψηλούς τίτλους TG).
Σε κάθε περίπτωση, η μετεγχειρητική φροντίδα των καλά διαφοροποιημένων καρκινωμάτων εστιάζεται στην χορήγηση κατασταλτικών δόσεων λεβοθυροξίνης, με στόχο συγκεντρώσεις TSH ορού <0,05 mU/l. Η τακτική αυτή μειώνει την θνητότητα σε περιπτώσεις θηλώδους καρκινώματος, όπως και την πιθανότητα υποτροπών και στους δύο τύπους του καλά διαφοροποιημένου θυρεοειδικού καρκινώματος. Οι συνιστώμενες ημερήσιες δόσεις λεβοθυροξίνης είναι της τάξης των 150-200 μg και άνω (τουλάχιστον 2 μg/kg/ ημέρα), ώστε να διατηρηθούν τα επιθυμητά επίπεδα ορμονών στην κυκλοφορία, με επαρκή καταστολή της TSH. Συνήθως η δόση του φαρμάκου αυξάνει κατά την 5η εβδομάδα κύησης και τα επίπεδα της fT4 όσο και της TSH πρέπει να ελέγχονται κάθε 6 εβδομάδες για ικανοποιητική ρύθμιση της δόσης. Μετά τον τοκετό η δόση του φαρμάκου επαναπροσδιορίζεται στα προ της εγκυμοσύνης επίπεδα, ενώ η παρακολούθηση των τιμών της TSH πρέπει να συνεχίζεται.
Εφόσον ανιχνευθούν αντισώματα έναντι της θυρεοειδικής υπεροξειδάσης (TPO-Abs) και τιμές TSH >2,5 mIU/l, θα πρέπει να γίνει έναρξη της λεβοθυροξίνης κατά το πρώτο τρίμηνο της κύησης. Επιπρόσθετα, εγκυμονούσες με θεραπευμένο καλά διαφοροποιημένο καρκίνωμα που όμως δεν έχει την αναμενόμενη βιοχημική ή και απεικονιστική ανταπόκριση στην θεραπεία ή γίνονται εμφανή σημεία εμμένουσας νόσου ή υποτροπής, θα πρέπει να υποβάλλονται σε τακτικό έλεγχο με υπερηχογράφημα τραχήλου και μέτρηση των τιμών θυρεοσφαιρίνης ορού. Κάτι τέτοιο δεν απαιτείται σε άτομα προηγουμένως θεραπευμένα από καλά διαφοροποιημένο καρκίνωμα χαμηλού κινδύνου με μη ανιχνεύσιμα επίπεδα θυρεοσφαιρίνης και αρνητικό υπερηχογραφικό έλεγχο.
Σε ασθενείς με μυελοειδές καρκίνωμα θυρεοειδούς, το οποίο γενικά δεν επηρεάζεται από την TSH, δεν ενδείκνυται η θεραπεία καταστολής, αλλά μόνο λεβοθυροξίνη ως ορμονική υποκατάσταση μετά το χειρουργείο, με την δοσολογία να είναι στα επίπεδα που χρησιμοποιούνται στον υποθυρεοειδισμό.
Συμπερασματικά η κυοφορία μετά την αποτελεσματική θεραπεία της νόσου δεν φαίνεται να επηρεάζει την επιβίωση, την θνητότητα και τα διαστήματα ελεύθερα νόσου, ανεξάρτητα από την στιγμή της διάγνωσης, με την προϋπόθεση ότι δεν υπάρχει υπολειπόμενη νόσος την στιγμή της σύλληψης ή ενδείξεις υποτροπής. Σε αντίθετη περίπτωση οι ασθενείς με υπολειμματική ή υποτροπιάσασα νόσο είναι πιθανότερο να παρουσιάσουν επιδείνωση κατά την πορεία της κύησης.
Λοχεία – θηλασμός
Η διαχείριση των θυρεοειδικών όζων μετά τον τοκετό ακολουθεί τους ίδιους κανόνες που εφαρμόζονται και στις γυναίκες που δεν κυοφόρησαν. Στον καρκίνο του θυρεοειδούς που ανακαλύπτεται κατά την περίοδο της λοχείας ή του θηλασμού θα πρέπει να ληφθεί κατάλληλη μέριμνα για το χρόνο που θα πραγματοποιηθεί το χειρουργείο και η επικουρική θεραπεία με ραδιενεργό ιώδιο. Το ραδιενεργό ιώδιο έχει απόλυτη αντένδειξη στον θηλασμό καθώς συσσωρεύεται στο μητρικό γάλα. Γι’ αυτό προτείνεται φαρμακευτική διακοπή του θηλασμού τουλάχιστον 3 μήνες πριν από οποιαδήποτε θεραπεία με ραδιενεργό ιώδιο 131. Εναλλακτικά, το ραδιενεργό ιώδιο 123, με το μικρότερο χρόνο ημιζωής του (13 ώρες, έναντι 8 ημερών), μπορεί να χρησιμοποιηθεί με την προϋπόθεση ότι το γάλα θα συλλέγεται και θα απορρίπτεται τις πρώτες 3 – 4 ημέρες μετά την θεραπεία.
Κατευθυντήριες οδηγίες
Στις κατευθυντήριες οδηγίες που αφορούν το καρκίνωμα του θυρεοειδούς αδένα κατά την διάρκεια της εγκυμοσύνης, αναφέρεται ότι η επίπτωση της νόσου στις εγκύους είναι 14:100.000, με το θηλώδες καρκίνωμα να είναι το πιο συχνό. Η διάγνωση του θυρεοειδικού καρκίνου στην εγκυμοσύνη γίνεται με την λήψη λεπτομερούς ατομικού και οικογενειακού ιστορικού και την ενδελεχή φυσική εξέταση. Ο έλεγχος της TSH κρίνεται απαραίτητος και σε περιπτώσεις που αυτή παραμένει σε χαμηλά επίπεδα μετά την 16η εβδομάδα κύησης, γίνεται FNA του ύποπτου όζου. Η διαγνωστική αξία του υπερηχογραφήματος παραμένει υψηλή για τον εντοπισμό ύποπτων όζων του θυρεοειδούς αδένα κατά την εγκυμοσύνη, ενώ FNA συστήνεται σε πρωτο-εμφανιζόμενους όζους είτε κατά την διάρκεια της εγκυμοσύνης είτε μετά τον τοκετό, αναλόγως του κινδύνου του καρκίνου και της προτίμησης της ασθενούς. Το σπινθηρογράφημα δεν συστήνεται στην εγκυμοσύνη, ενώ η αξία του ελέγχου της καλσιτονίνης παραμένει διφορούμενος.
Η ολική θυρεοειδεκτομή στην διάρκεια της εγκυμοσύνης επιβάλλεται στην περίπτωση μυελοειδούς και αναπλαστικού καρκινώματος, όπου η αναβολή του χειρουργείου θα έχει δυσμενή αποτελέσματα στην εξέλιξη της νόσου και στην περίπτωση του θηλώδους καρκινώματος που αυξάνεται σε μέγεθος ραγδαία έως την 24-26 εβδομάδα της εγκυμοσύνης ή δίνει διηθημένους τραχηλικούς λεμφαδένες. Το προτιμητέο τρίμηνο εγκυμοσύνης για πραγματοποίηση της θυρεοειδεκτομής θεωρείται το δεύτερο προς αποφυγή μητρικών και εμβρυϊκών επιπλοκών.
Σε προηγηθείσα ολική θυρεοειδεκτομή για καλά διαφοροποιημένο καρκίνωμα θυρεοειδή αδένα, η υπερηχογραφική παρακολούθηση και η μέτρηση των τιμών της θυρεοσφαιρίνης κατά την διάρκεια της εγκυμοσύνης συστήνεται μόνο στις περιπτώσεις υπολειμματικής νόσου ή υποτροπής ή σε περιπτώσεις ατελούς απόκρισης στην θεραπεία.
Καταληκτικά, αν και η επίδραση της ακτινοβολίας στην εξέλιξη των μελλοντικών γεννήσεων παραμένει αμφιλεγόμενη, η αναβολή της κύησης για άλλοτε άλλο χρονικό διάστημα, η σωστή αντισύλληψη και ο οικογενειακός προγραμματισμός, που θα καθοδηγούνται από μία έμπειρη ομάδα ειδικών επιστημόνων, αποτελούν την ασφαλέστερη πρακτική για σωστή αντιμετώπιση της νόσου αλλά και ελαχιστοποίηση της επίδρασης των θεραπειών στο μελλοντικό κύημα. Οι μέλλουσες μητέρες αλλά και όλοι οι ασθενείς που θα έρθουν αντιμέτωποι με την νόσο πρέπει να γνωρίζουν ότι η σωστή ενημέρωση, ο τακτικός έλεγχος και η εμπιστοσύνη στους θεράποντες συνιστούν τον ακρογωνιαίο λίθο για αποτελεσματική διαχείριση, που στις περισσότερες περιπτώσεις εγγυάται μία σχεδόν φυσιολογική μετέπειτα ζωή.
Θυρεοειδικοί όζοι στην εγκυμοσύνη
Οι θυρεοειδικοί όζοι είναι συχνοί στην εγκυμοσύνη, ενώ παρατηρείται αύξηση νεοεμφανιζόμενων όζων και αύξηση του μεγέθους των ήδη υπαρχόντων κατά την πορεία της. Ορισμένες μελέτες υποστηρίζουν διπλασιασμό του μεγέθους των ήδη υπαρχόντων όζων, ενώ άλλες κάνουν λόγο για πιο μικρής έκτασης αύξηση που συχνά διαλάθει της προσοχής. Στο 20% των γυναικών που διαγιγνώσκονται με όζο κατά το πρώτο τρίμηνο της κυοφορίας θα εμφανιστεί και δεύτερος όζος μέχρι τον τοκετό. Η συχνότητα ανεύρεσης θυρεοειδικών όζων σε υπερηχογράφημα τραχήλου κατά την διάρκεια της κύησης κυμαίνεται από 3% έως 30% και σχετίζεται με την μεγάλη ηλικία της μητέρας στην εγκυμοσύνη. Πολλές φορές οι όζοι συγχέονται με την φυσιολογική αύξηση του αδένα κατά την εγκυμοσύνη. Η πιθανότητα ένας όζος που θα βρεθεί τυχαία να υποκρύπτει κακοήθεια δεν είναι γνωστή. Στην περίπτωση που βρεθεί συμπτωματικά κάποιος όζος στο θυρεοειδή κατά την διάρκεια της κύησης, θα πρέπει οπωσδήποτε να αξιολογηθεί η πιθανότητα κακοήθειας.
Διάγνωση
Όπως και στο γενικό πληθυσμό, το καλό ιατρικό ατομικό και οικογενειακό ιστορικό και η λεπτομερής φυσική εξέταση αποτελούν την βάση για την ορθή διάγνωση. Πληροφορίες σχετικά με προηγούμενη έκθεση σε ιονίζουσα ακτινοβολία ή περιστατικά κακοήθειας στο οικογενειακό περιβάλλον της ασθενούς είναι καθοριστικής σημασίας. Σημαντικός εργαστηριακός δείκτης είναι η TSH. Συνήθως η τιμή της είναι φυσιολογική σε άτομα με όζους. Χαμηλή TSH σε μη εγκυμονούσες γυναίκες υποδηλώνει όζο που υπερλειτουργεί και πρέπει να αξιολογηθεί με σπινθηρογράφημα θυρεοειδούς. Αντίθετα σε έγκυες, η φυσιολογική μείωση των τιμών της TSH λόγω της δράσης της HCG αλλά και η απόλυτη αντένδειξη διενέργειας σπινθηρογραφήματος, αποτελούν πρόκληση για την διαφορική διάγνωση των όζων. Τέλος, η παρακολούθηση των τιμών της θυρεοσφαιρίνης (TG) ορού και της καλσιτονίνης ως εξετάσεις ρουτίνας δεν συστήνεται, παρά μόνο για τον αποκλεισμό του μυελοειδούς καρκινώματος. Το υπερηχογράφημα τραχήλου αποτελεί αξιόπιστη μέθοδο διάγνωσης των όζων και των χαρακτήρων τους στην εγκυμοσύνη. Υπερηχογραφικά στοιχεία που συνηγορούν υπέρ κακοήθειας είναι τα ανώμαλα και υποηχογενή όρια της βλάβης, η αυξημένη και άναρχη αγγείωση, οι μικροεπασβεστώσεις, η απουσία περιφερικής άλω, οι όζοι μεγαλύτεροι επιμήκως απ’ ό,τι εγκάρσια, επέκταση στους πέριξ ιστούς και παρουσία παθολογικών λεμφαδένων. Η ύπαρξη δύο τουλάχιστον κριτηρίων διαγιγνώσκει τις κακοήθειες σε ποσοστό 90%. Αυτά τα χαρακτηριστικά σύμφωνα με τις κατευθυντήριες οδηγίες της ATA (American Thyroid Association) θέτουν την ένδειξη για περαιτέρω έλεγχο της βλάβης με κυτταρολογική εξέταση του όζου με λεπτή βελόνη (FNA). Η τεχνική FNA είναι ασφαλής και ακριβής και συστήνεται για την αξιολόγηση ενός ύποπτου θυρεοειδικού όζου κατά την εγκυμοσύνη και μπορεί να πραγματοποιηθεί σε οποιοδήποτε στάδιο. Όζοι <1 cm γενικά δεν χρειάζονται βιοψία, παρά μόνο επί υψηλής κλινικής ή απεικονιστικής υποψίας. Η ερμηνεία των αποτελεσμάτων της κυτταρολογικής εξέτασης του υλικού της βιοψίας γίνεται με βάση την κατηγοριοποίηση Bethesda, όπου καταδεικνύεται ο βαθμός κακοήθειας των κυττάρων, με βάση τα ίδια κριτήρια που χρησιμοποιούνται και στο γενικό πληθυσμό. Σε νεαρές ασθενείς είναι σπάνιο να βρεθεί αμιγώς θυλακιώδης καρκίνος εξαιτίας της μικρής επίπτωσης. Συνήθως απαντώνται θυλακιώδεις παραλλαγές των θηλωδών καρκινωμάτων, οι οποίες δεν είναι ιδιαίτερα επιθετικές. Στις περιπτώσεις που η βιοψία δείξει νεόπλασμα από κύτταρα Hurthle η θεραπεία οφείλει να είναι πιο επιθετική. Το σπινθηρογράφημα θυρεοειδούς με ραδιενεργά υλικά αντενδείκνυται απόλυτα στην εγκυμοσύνη, επομένως το υπερηχογράφημα και η κυτταρολογική εξέταση με FNA είναι οι μόνες ασφαλείς και αξιόπιστες τεχνικές για την αξιολόγηση των θυρεοειδικών όζων κατά την κύηση.
Αντιμετώπιση
Μολονότι η φυσική εξέλιξη των θυρεοειδικών όζων επηρεάζεται από την κύηση και οι κατασταλτικές δόσεις λεβοθυροξίνης οδηγούν σε μείωση του μεγέθους κατά 20%, η στρατηγική αυτή δεν συστήνεται εξαιτίας του κινδύνου της ιατρογενούς θυρεοτοξίκωσης. Οι όζοι που αποδεικνύονται καλοήθεις πρέπει απλά να παρακολουθούνται όπως και στο γενικό πληθυσμό, ενώ οι όζοι αμφιβόλου κινδύνου μπορούν να παρακολουθούνται στην διάρκεια της κύησης, αν και στην πλειοψηφία τους είναι καλοήθεις.